作為抗血小板凝聚藥物廣泛使用的阿司匹靈的抗腫瘤效果近年來也備受關注,成為以預防和治療癌症為目的的藥物重定位的最有力候補。不過,阿司匹靈的副作用,如消化性潰瘍和出血傾向等也不容忽視,因此業界正全力探索能提前預測阿司匹靈抗腫瘤效果的生物標誌物,以及開發旨在更安全有效地提高阿司匹靈抗腫瘤效果的聯用治療藥物。
在這一過程中,隨著癌症基因體解析的進步,阿司匹靈的抗腫瘤效果與癌症基因體之間的關係變得明確,尤其是對於佔大腸癌10~20%的PIK3CA基因突變大腸癌,近年來接連報告了證明阿司匹靈高度有效的臨床數據。不過目前還不清楚其詳細機制,全球正在對此開展基礎研究。
另一方面,已知癌細胞不同於正常細胞,各種代謝路徑的異常會支持細胞過度繁殖,在PIK3CA基因突變癌細胞中,氨基酸代謝之一的麩醯胺代謝也被激活,對此,京都府立醫科大學和關西醫科大學的研究團隊假設「PIK3CA基因突變引起的麩醯胺代謝增強可能會影響阿司匹靈的敏感性」,並推進了相關研究。
研究内容和成果的要點
首先,研究團隊驗證了阿司匹靈的效果預測因子——PIK3CA基因突變發生與否,以及細胞培養液中有無麩醯胺是否會影響阿司匹靈抑制細胞繁殖的效果。結果發現,在發生PIK3CA基因突變的大腸癌細胞中,去除培養液中的麩醯胺後,對阿司匹靈的敏感性會降低(圖1)。
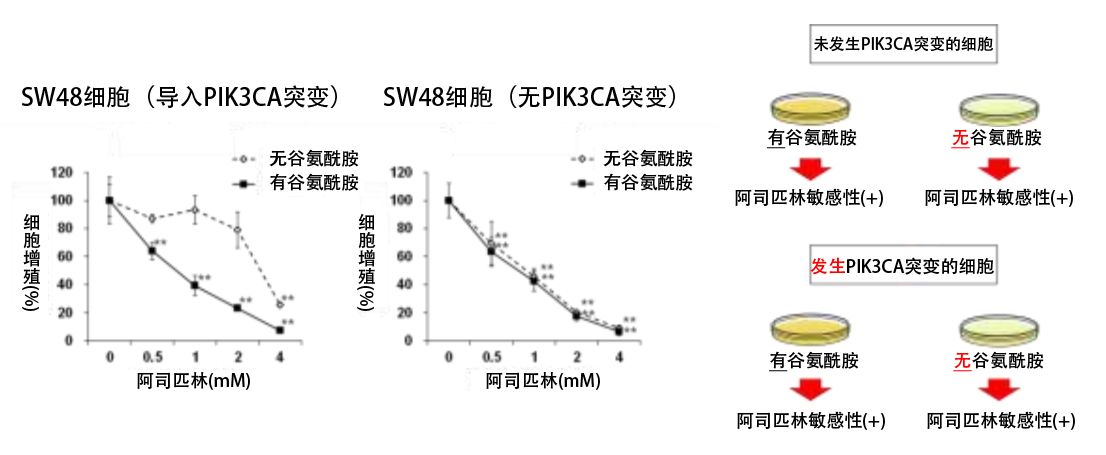
圖1:利用PIK3CA突變(±)SW48細胞分別在培養基中有麩醯胺和沒有麩醯胺的情況下比較了阿司匹靈的抗腫瘤效果,發現僅在PIK3CA突變細胞中,去除麩醯胺會降低對阿司匹靈的敏感性。
接下來利用分子生物學方法確認,去除培養液中的麩醯胺時誘導的氨基酸代謝的主調節因子——轉錄因子ATF4在添加阿司匹靈時也會被誘導表達。這表明,阿司匹靈可能會促進癌細胞吸收麩醯胺。因此,研究團隊利用綜合基因解析法 (RNA-seq)解析了阿司匹靈處理對基因表現的影響,發現與掌管細胞吸收氨基酸的轉運蛋白有關的基因簇表達出現了增加(圖2)。
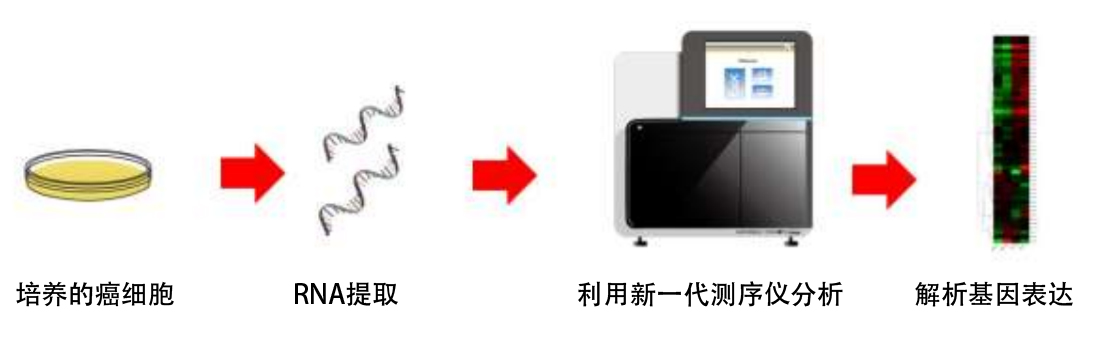
圖2:利用新一代測序儀對癌細胞全面進行基因解析(RNA-seq)確認,阿司匹靈會激活與麩醯胺代謝有關的基因。
另外還發現,利用阿司匹靈處理後,多種與麩醯胺代謝有關的酶的表達增強,由此得出一個以前不知道的新發現,即「阿司匹靈通過誘導ATF4表達,會激發癌細胞内的麩醯胺代謝」。為將阿司匹靈用於癌症預防和治療,研究團隊同時使用阿司匹靈和多種麩醯胺代謝抑制劑,對PIK3CA大腸癌細胞進行了長時間(1周)處理,發現了對抑制癌細胞集落的形成具有統合抑制效果。
這表明,被阿司匹靈激發的麩醯胺代謝通過氧化壓力誘導耐性和能量代謝迴路的活性,對癌細胞的存活產生了重要意義,同時也表明,阿司匹靈和麩醯胺代謝抑制劑聯用的治療方法與單獨使用阿司匹靈治療相比,可能是更有效的治療方案(圖3)。
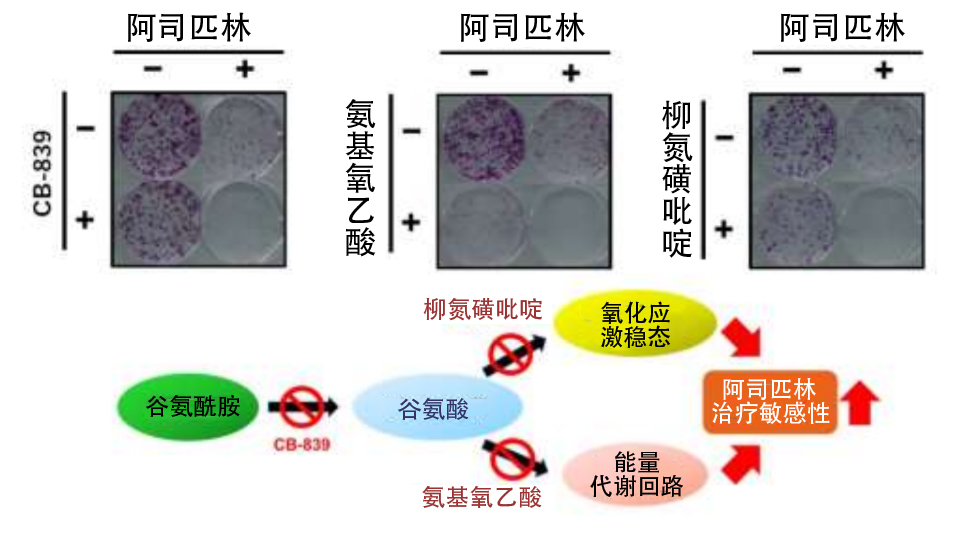
圖3:通過藥劑抑制阿司匹靈激活的麩醯胺代謝,能與阿司匹靈發揮出統合抗腫瘤效果。
結論
本研究表明,在PIK3CA突變大腸癌中,如果缺乏麩醯胺,阿司匹靈就無法充分發揮抗腫瘤效果。
另外,本次研究還從分子機制上證明了阿司匹靈會激活麩醯胺的代謝。而通過抑制被阿司匹靈激活的麩醯胺代謝,則有望提高阿司匹靈的抗腫瘤效果。
論文資訊
題目:Deactivation of Glutaminolysis Sensitizes PIK3CA-Mutated Colorectal Cancer Cells to Aspirin-Induced Growth Inhibition
期刊:《Cancers》
DOI編號:2072-6694/12/5/1097
文:JST客觀日本編輯部














