日本國立研究開發法人量子科學技術研究開發機構量子醫學醫療部門放射線醫學綜合研究所先進核醫學基礎研究部門的博士研究員胡寬,部長張明榮教授等人與與美國哈佛大學布萊根婦女醫院Wei Tao教授課題組,中國暨南大學王璐教授課題組和哈佛大學麻省總醫院Steven Liang 教授課題組合作,開發成功了一種新的基於BPNS的光熱劑,為兼具良好的「光熱穩定性」和「快速降解性能」提供了一種可行的解決方案。該最新成果發表在《自然》子刊《Nature Communications》,題為「Marriage of black phosphorus and Cu2+ as effective photothermal agents for PET-guided combination cancer therapy」。
【開發背景】
作為一種微創、精確可控和治療效果良好的治療模態,光熱治療(PTT)-一種利用光熱材料將發光能量轉化為局部過熱,從而殺死癌細胞的治療方式,近年來在前臨床和臨床實務中獲得了可喜的成就。在最近的一項臨床前瞻性實驗中,美國科學家將金-硅奈米殼 (gold-silica nanoshells, GSN)用於局部熱冰融前列腺内的低中度腫瘤,結果鼓舞人心—— 在94%(15/16)的患者中成功實現了GSN介導的聚焦雷射冰融,並且展現出良好的安全性。此外,氧化鐵奈米顆粒 (NanoTherm, Magforce)已在歐洲被批准用於臨床光熱治療。由於上述臨床應用方面的顯著進展,使得腫瘤光熱治療成為一種前景巨大的治療模式,將對癌症的臨床治療實務產生重要的意義。
儘管如此,作為光熱治療的基石和關鍵組成部分——光熱劑(PTA),仍然存在著不足和改善的空間。一種理想的光熱劑必須同時滿足多個條件,其中就包括: (1) 優良的光熱轉化效率和光熱穩定性;(2)快速的體內降解並被代謝排出體內,以降低潛在的副作用。目前報導的光熱劑,如無機奈米材料,具有很高的光熱穩定性和光熱轉化效率,然而,這些奈米顆粒很難被活體代謝,通常在體內停留數月甚至更長時間,帶來了相應的安全隱患。還有一些其他的有機光熱分子,如吲哚菁綠(ICG),雖然表現出令人滿意的生物安全性,但是,快速的體內清除使得它們的光熱穩定性難以滿足臨床光熱治療的需求。此外,頻繁的施加雷射照射,將進一步加速有機光熱劑的降解。雖然光熱穩定性的問題可以通過提升注射劑量來解決,但是,這也將導致更高的代謝器官(如肝臟和腎臟)負荷,從而引發新的臨床問題。上述大多數傳統光熱劑在「光熱穩定性」和「快速降解」兩方面的互不相容的矛盾,是目前發展光熱療法亟需解決的瓶頸問題。
如果將光熱劑的「光熱穩定性」和「快速降解性」比作硬幣的兩面,那麼,如何通過巧妙的設計,使硬幣「站立」,同時展現出優良的光熱穩定性和快速降解性,從而實現「理想」的光熱治療,是目前該領域尚未解決的重要科學問題。黑磷奈米片(BPNS),是一種生物相容且可降解的二維奈米材料。作為一種光熱劑,目前已被廣泛應用於前臨床腫瘤光熱治療。但是,BPNS是一種對水-氧環境易感的材料,在體內會快速被降解成磷氧化合物(PxOy), 從而失去光熱治療性能。儘管目前已有多種通過對BPNS進行共價或者非共價的修飾方法來對黑磷的光熱穩定性進行改善,但是,這種改善是以損失優異的降解性能作為代價。如何在不損失BPNS的降解性能的基礎上,提升BPNS的光熱性能和治療效果,從而實現「魚和熊掌」 兼得,是科學家追求的目標之一。
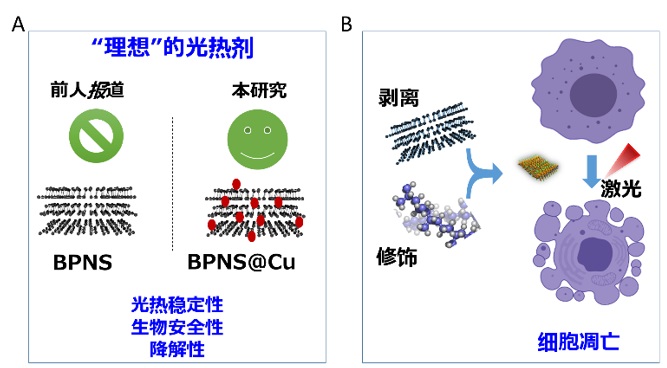
圖一. 研究出發點和研究内容示意圖
【研究方法和成果】
研究人員將二價金屬銅離子(Cu2+)與BPNS進行有機結合,實現了「一舉多得」的效果。該設計的優勢主要表現為: (1) BPNS可以高效負載Cu2+; (2)基於Cu的奈米材料(如硫化銅奈米顆粒)是良好的光熱劑,因此,BPNS 與 Cu 可以實現統合光熱作用,進一步提升光熱治療性能;(3)Cu(II) 可以與P(0) 發生氧化還原反應,從而促進BPNS的降解;(4)反應生成的Cu(I)離子是一種類Fenton 反應觸媒,可以與腫瘤微環境中的H2O2發生反應,從而產生高濃度的•OH自由基,殺傷癌細胞,進而實現化學動力學治療(Chemodynamic therapy)聯合的光熱治療; (5) Cu-64是一種常用的對奈米藥物進行示蹤的正電子發射核素,可以用於正電子發射斷層掃描成像(PET)和b-線治療,目前已用於多項臨床研究。
本設計中,研究人員通過對BPNS進行Cu-64標記,不會改變奈米藥物的本來的結構,從而實現了對奈米藥物精準的體內動態和代謝的示蹤和反映。與傳統的光學成像(如近紅外光,光聲成像)相比,具有可全身動態監測,定量計算,臨床實務零距離等多方面的優勢,為未來基於BPNS的奈米藥物的臨床轉化奠定了基礎。
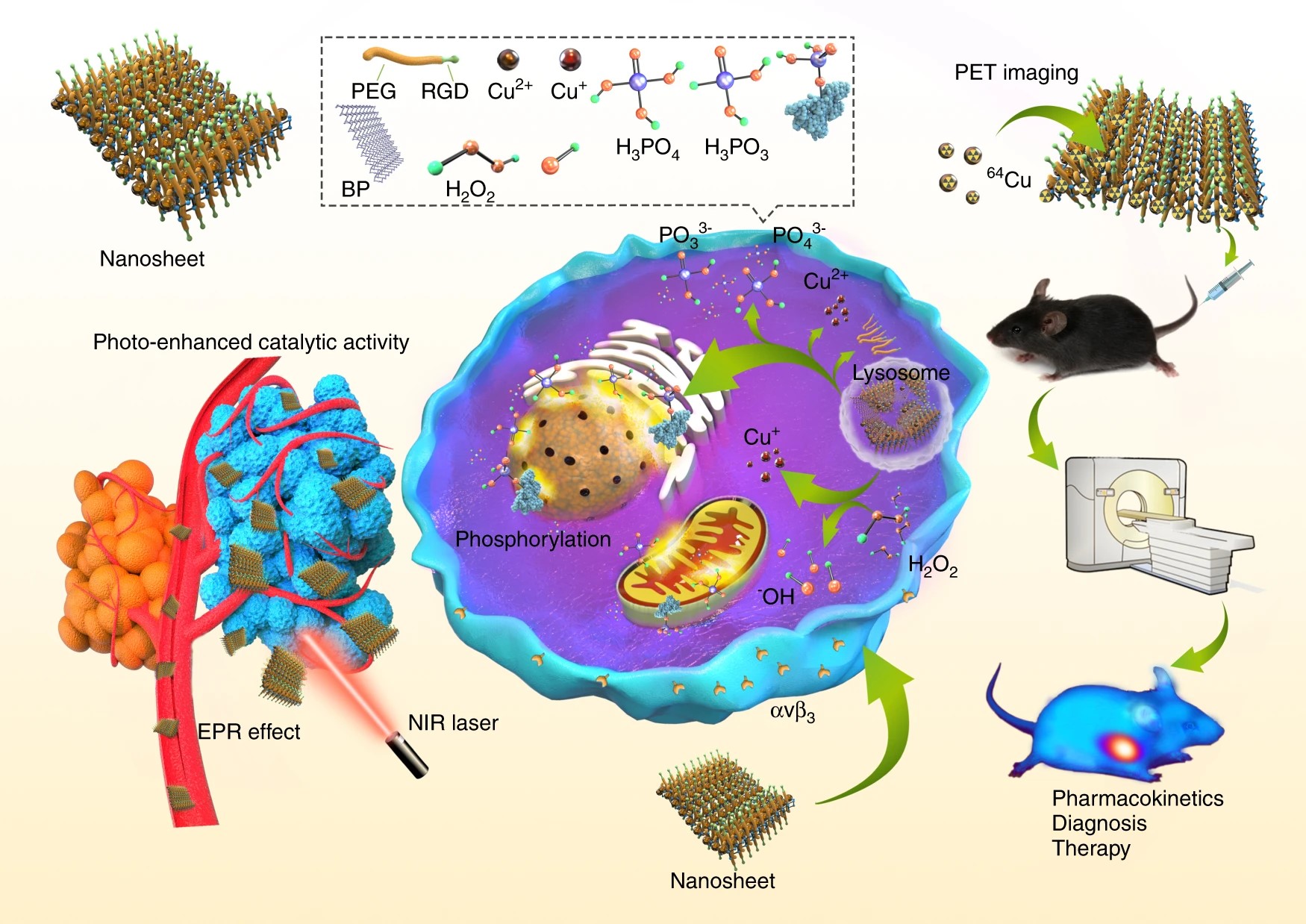
圖二. 基於BP@Cu的奈米藥物的光熱治療研究示意圖。
在實驗結果部分,研究人員首先研究了BPNS與Cu(II)之間的相輔作用,通過一系列表徵手段,如TEM, AFM, UV-VIS-IR,Raman, XPS, EPR等,證實了BPNS 與 Cu(II) 發生了氧化還原反應,生成了Cu(I)。隨後,研究了BP@Cu 複材的光熱性能,結果表明:Cu(II)與BPNS 產生了光熱效果互利共生,在808 nm的雷射照射下,BPNS@Cu釋放出更多的熱量。為了提升BP@Cu的體外穩定性,研究人員進一步用PEG對BP@Cu進行了包裹,並在表面修飾了整聯素蛋白(integrin avb3)的靶向多肽(cyclo-RGD)。隨後,研究人員選取了多種腫瘤細胞對BP@Cu@PEG-RGD的生物學效應進行了評價。結果顯示:負載了Cu(II)的BPNS具有比BPNS更好的癌細胞殺傷效果。在隨後細胞作用機制研究中,研究人員證實了BP@Cu誘導了癌細胞内更高的活性氧(ROS)水平,從而使癌細胞發生凋亡和細胞週期抑制。

圖三. 原子力顯微鏡對合成的BP@Cu奈米片進行表徵:黑磷-銅奈米片誘導癌細胞發生凋亡。
完整的體內藥代動力學和代謝排洩途徑的研究,是奈米藥物進行臨床實驗前不可缺少的重要一環。日本國立放醫研先進核醫學研究部(部長張明榮教授)在過去數十年,專注於PET藥物的開發和臨床轉化。在Cu-64標記的藥物方面,目前有多種新藥正在進行臨床實驗。基於該部門豐富的藥物轉化經驗和完備的放藥生產轉化平台,研究人員對BPNS的體內分佈,動態,腫瘤富集能力,排洩途徑進行了全面的評價。與其他奈米藥物類似,BP@Cu@PEG-RGD 通過尾靜脈注射以後,會迅速被肝臟和脾臟吸收,但是隨著BPNS的緩慢降解,這些奈米藥物的尺寸會逐步縮小,並最終從脾臟和肝臟逃逸,重新進入血液循環。最終隨著不斷降解,部分BPNS將會被腎臟-膀胱通路排出體內。研究人員還考察了BP@Cu@PEG-RGD的腫瘤富集能力。在多種皮下腫瘤模型中,BP@Cu@PEG-RGD展現出在腫瘤組織的不斷累積作用,並在18小時左右達到最高點。這些結果為隨後施加光熱治療和制定給藥方案提供了重要的參考。
最後,研究人員研究BP@Cu奈米藥物的腫瘤治療效果。結果表明,通過尾靜脈注射奈米藥物,並在808 nm 雷射的照射下,BP@Cu0.4@PEG-RGD 治療的腫瘤幾乎被完全抑制。形成鮮明對比的是,BP@Cu0.4 以及BP@Cu0.4@PEG 治療的腫瘤治療效果不佳。這是由於BPNS 在腫瘤部位的富集主要是由RGD 介導。最終,研究人員用PET評價了治療效果,並進一步強調了PET作為診斷方法在奈米藥物開發和治療效果評價方面的重要作用。
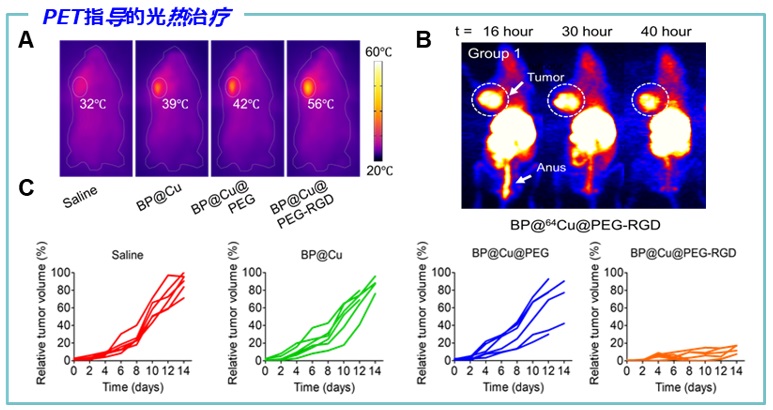
圖四. (A)小鼠的近紅外光熱成像照片。(B) 小鼠的PET圖像。(C)小鼠的腫瘤生長曲線。
通過該項研究,研究人員針對目前光熱劑存在的不足,提出了一種新的提升BPNS 光熱治療效果的方案,嘗試開發一種理想的光熱劑-兼具良好光熱穩定性和降解性能的奈米藥物,並通過PET成像,確定了治療效果,為今後推動BPNS的臨床應用打下了堅實的基礎。
【論文資訊】
題目:Marriage of black phosphorus and Cu2+ as effective photothermal agents for PET-guided combination cancer therapy
雜誌:Nature Communications
doi.org/10.1038/s41467-020-16513-0
文:胡寬
編輯修改:JST 客觀日本編輯部













