橫濱市立大學研究生院醫學研究科器官再生醫學領域的谷口英樹教授和關根圭輔客座副教授等人組成的研究團隊,與東京大學醫科學研究所和榮研化學公司等合作,開發出了在利用人iPS細胞分化誘導肝臟細胞等各種細胞時,可高靈敏度地檢測出可能會微少殘留的未分化iPS細胞的方法。
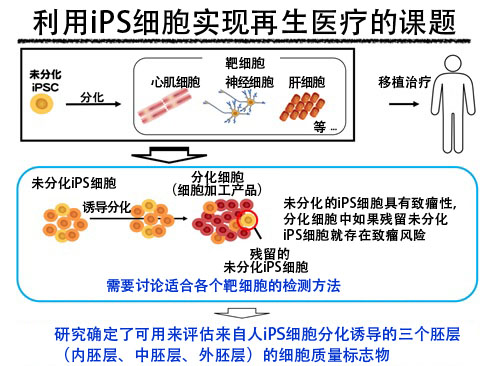
研究背景
用於再生醫療的人iPS細胞分化誘導的功能細胞(器官細胞)很難做到所有細胞完全分化,可能會存在一些未分化的iPS細胞。未分化的iPS細胞移植到體內可能會形成畸胎瘤,為患者移植功能細胞前,需要評估混入未分化iPS細胞的可能性。目前,研究團隊的目標是將2013年確立的迷你肝臟培養技術應用於再生醫療,但肝臟的再生醫療需要移植大量細胞,因此需要一種能在培養過程中以高靈敏度快速檢測未分化iPS細胞的方法。
此前報告過幾種評估混入的未分化iPS細胞的方法,所以研究團隊嘗試利用這些評估法使用的標記基因,但發現這些標記基因在肝臟的正常發育過程中也會表達。因此,利用人iPS細胞進行分化誘導時,無法區分是作為正常的肝細胞表達,還是混入了未分化的iPS細胞,所以標記基因並不適合作為評估方法使用。
此次以之前研究人iPS細胞源迷你肝臟獲得的單細胞水平全基因表現資訊為基礎,開發出了適合評估迷你肝臟品質的方法。
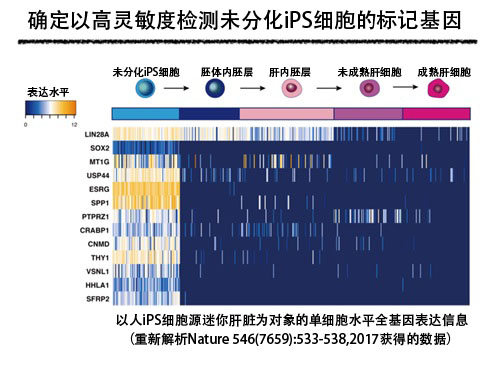
研究内容
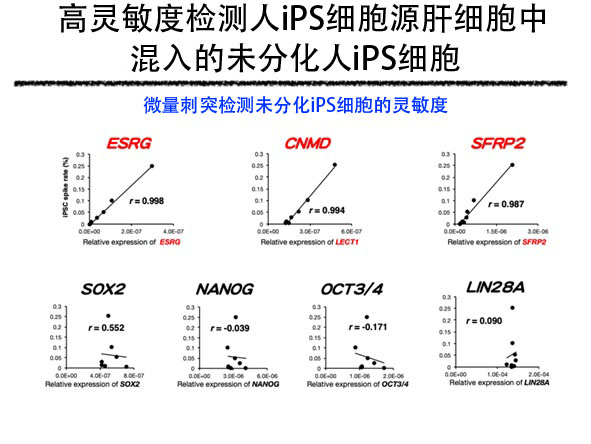
首先,研究團隊重新解析了此前研究人iPS細胞源迷你肝臟時獲得的單細胞水平全基因表現資訊,作為可檢測混入分化細胞中的未分化iPS細胞的標記,提取出12種在未分化iPS細胞中的表達水平格外高、而在分化細胞中的表達減少的基因。研究團隊詳細解析了這12種基因的基因表現,並實施了在分化細胞中混入未分化iPS細胞後檢測混入的未分化iPS細胞的試驗等,發現ESRG、CNMD和SFRP2三種基因在人iPS細胞源肝細胞中混入未分化iPS細胞時,能以高靈敏度檢測出,可用來評估再生醫療用細胞的品質。人iPS細胞源迷你肝臟除肝細胞外,還使用人iPS細胞源血管內皮細胞和人iPS細胞源間充質細胞,因此研究團隊還考慮了是否也能用來評價這些細胞中混入的未分化iPS細胞。研究發現,在人iPS細胞源血管內皮細胞和人iPS細胞源間充質細胞中,也能用來高靈敏度檢測混入的未分化iPS細胞。
脊椎動物在發育初期會形成內胚層、中胚層和外胚層三種胚層(三胚層),其中,內胚層發育形成肝臟、肺、腸和胰臟等,中胚層形成血管、間充質細胞和心肌細胞等,外胚層形成神經和皮膚等。本次研究確定的標記基因在源自內胚層的細胞(肝臟、胰臟)和源自中胚層的細胞(血管內皮細胞、間充質細胞)中有效,因此研究團隊又研究了在源自外胚層的細胞——神經細胞中是否有效。研究發現,在人iPS細胞源神經細胞中,也能以高靈敏度有效檢測出混入的未分化iPS細胞。這些結果表明,本研究確定的標記基因在實現採用人iPS細胞的再生醫療時,不僅是人iPS細胞源迷你肝臟,還有望用來評價各種器官的細胞品質。
通過用本次研究開發的技術評估再生醫療用迷你肝臟培養過程中的品質,可以顯著降低因混入未分化iPS細胞而產生的致瘤風險,能大幅提高移植患者的臨床安全性。另外,不僅是迷你肝臟,該技術還有望用來評價採用人iPS細胞的其他細胞、組織和器官的培養過程中的品質。目前正通過產學合作的方式推進該技術的發展,開發旨在進一步提高檢測靈敏度和檢測精度的技術。
用語解說
迷你肝臟:通過以最佳比例混合利用人iPS細胞分化誘導的肝內胚層細胞、血管內皮細胞和間充質細胞,在體外培養條件下自主創造的肝臟基礎——立體肝芽(迷你肝臟)。另外據報告,通過將這種創新的三維培養技術(器官原基法)應用於其他器官的培養,不僅是肝臟,還利用從胰臟、腎臟、腸、肺、心臟和腦分離的細胞製造了三維器官原基。製造的三維器官原基能在移植後立即重建具有血流的血管網路,並自主形成功能性組織。
■論文資訊
題目:Robust detection of undifferentiated iPSC among differentiated cells
期刊:《Scientific Reports》
URL:nature.com/articles/s41598-020-66845-6
文:JST客觀日本編輯部














