日本東京醫科齒科大學生體材料工學研究所有機生體材料學專業的西田慶博士、田村篤志副教授和由井伸彥教授等人組成的研究團隊,於全球率先設計出了使超分子聚合體聚輪烷與靶向癌症的抗體結合的「抗體-超分子結合體」,成功克服了對癌細胞沒有選擇性以及難以吸收進細胞内的問題。
【研究背景】
聚輪烷是聚合物貫穿環狀糖類環糊精空腔部的超分子聚合體,作為入選2016年諾貝爾化學獎的分子機器的代表一直備受關注。近年來推進了將源自聚輪烷獨特結構的物理可用能特性應用於材料的研究,以及在醫藥材料和生物材料方面的用途。研究團隊此前於全球率先發現,含有甲基化β-環糊精(Me-β-CD)的聚輪烷(Me-PRX)會在細胞内分解並釋放Me-β-CD,從而誘導自噬細胞死亡。Me-PRX引起的自噬細胞死亡對於已經對其他細胞死亡——程式性細胞死亡後天抗性的細胞也有效,在癌症治療方面的應用備受期待。不過,這種方法存在對癌細胞沒有選擇性,以及難以被吸收到細胞内的問題。
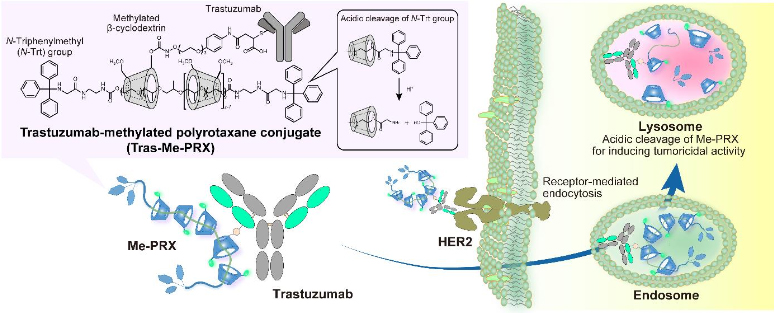
圖1:抗體-超分子結合體(Trasutuzmab-Me-PRX)的結構以及對細胞的作用
研究成果
在此次的研究中,為了實施使Me-PRX積極靶向癌細胞,並通過Me-PRX選擇性地誘導自噬細胞死亡的分子設計,研究團隊提出了使癌細胞抗體與Me-PRX結合的抗體-超分子結合體(圖1)。抗體-超分子結合體有望通過抗體識別癌細胞,選擇性地被吸收到細胞内。抗體選擇了已知在惡性腫瘤中大量表達的HER2抗體Trastuzumab(Herceptin),合成了Trastuzumab-Me-PRX結合體(Tras-Me-PRX)。
為了評估Tras-Me-PRX被吸收到細胞内的情況,研究團隊採用BT-474細胞作為HER2陽性細胞系、HeLa細胞作為HER2陰性細胞系,通過螢光顯微鏡(共聚焦顯微鏡)觀察了利用螢光標記的Tras-Me-PRX(圖2),在螢光標記的Tras-Me-PRX在BT-474細胞的表面和内部確認到了螢光,由此確認,這種結合體識別了細胞表面的HER2並與其結合,而且被吸收到細胞内。
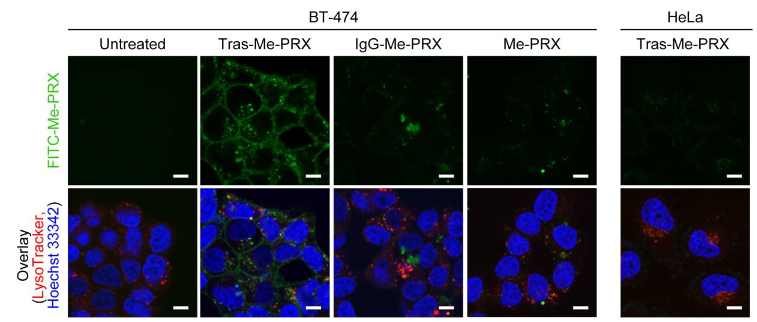
圖2:針對HeLa細胞和BT-474細胞的FITC標記Tras-Me-PRX、IgG-Me-PRX和Me-PRX的亞細胞定位(24小時,scale bars = 10μm)
另一方面,與不具備HER2識別能力的IgG結合的IgG-Me-PRX和Me-PRX單體則未在細胞表面觀察到螢光。HeLa細胞也沒有在細胞膜表面和内部觀察到螢光標記的Tras-Me-PRX。根據螢光強度評估螢光標記Tras-Me-PRX的吸收量發現,與Me-PRX單體相比,結合體的吸收量是其6~19倍。評估Me-PRX引起的細胞死亡發現,與Me-PRX相比,Tras-Me-PRX的半致死濃度(IC50)只有其10~60分之1(圖3)。估計這是因為抗體提高了被細胞吸收的效率。
以上結果表明,本次研究提出的抗體-超分子結合體的概念有望用作癌症化學療法的新平台。
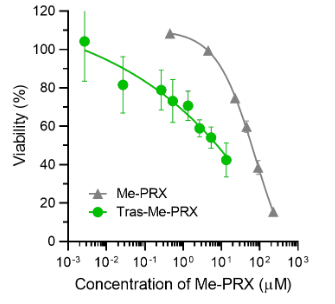
圖3:Tras-Me-PRX和Me-PRX發揮作用後的BT-474細胞的存活率(72小時)
研究成果的意義
此次設計的抗體-超分子結合體的功能有望成為已獲得治療抗性的癌細胞化學療法的新藥物形態之一。另外,從材料科學的角度來看,抗體-超分子結合體的設計及證明其有效性的研究史無前例,應該可以定位為關注度非常高的研究。
論文資訊
題目:An antibody–supermolecule conjugate for tumor-specific targeting of tumoricidal methylated β-cyclodextrin-threaded polyrotaxanesr
期刊:《Journal of Materials Chemistry B》
URL:pubs.rsc.org/en/content/articlelanding/2020/tb/d0tb00575d#!divAbstract
文:JST客觀日本編輯部














