京都大學的特定基地助教土井大輔(CiRA臨床應用研究部門)和高橋淳教授(CiRA臨床應用研究部門)組成的研究團隊,確認了來自臨床用人源iPS細胞的多巴胺神經祖細胞(DAP)的安全性和有效性,並確立了用於臨床試驗的品質標準(圖1)。對DAP的特性進行體外(in vitro)解析發現,其不含未分化的iPS細胞和增殖性早期神經幹細胞,癌症相關基因也沒有出現異常。另外,利用免疫缺陷小鼠實施的體內(in vivo)試驗也沒有發現細胞的致瘤性和毒性。此外,將DAP移植到PD模型大鼠的紋狀體發現,異常旋轉運動得到改善。研究團隊根據這些結果,於2018年針對PD患者啟動了細胞移植治療的臨床試驗(醫生主導的臨床試驗)。
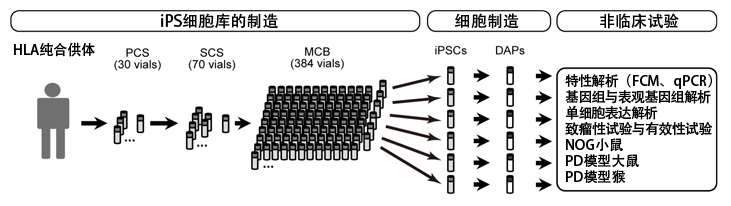
圖1:研究流程概要
FCM:流式細胞術,qPCR:定量PCR
研究背景
帕金森症(PD)是中腦黑質-紋狀體系統的多巴胺神經細胞脫落引起的神經退行性疾病,主要症狀表現為動作遲緩、震顫和肌肉僵直等,日本目前大約有17萬名患者。發病初期使用左轉多巴等藥物治療效果顯著,但由於不是疾病的根本性治療方法,隨著病情的發展,效果會減弱並可能出現副作用。外科療法有使用微電極的DBS(腦深部電刺激治療),但從長期來看效果同樣會減弱。通過移植來補充失去的多巴胺神經細胞的細胞移植治療作為更有望實現根治的新療法之一備受期待,在使用人類胎兒細胞的歐美臨床試驗中,部分病例取得了效果,包括運動症狀得到改善、無需再進行藥物治療等。不過,胎兒細胞存在細胞供應問題和倫理問題,因此,人富潛能幹細胞(ES細胞和iPS細胞)作為細胞來源備受期待,全球都展開了研究。
研究人員開發出了利用人富潛能幹細胞製作多巴胺神經細胞的培養方法,在齧齒類和靈長類動物的PD模型上顯示出有效性,研究已經進入可以臨床使用的階段。不過,使用富潛能幹細胞進行細胞治療的規則尚未在全球建立統一標準,目前各國都在根據各自的法律標準推進臨床應用。澳大利亞和中國已開始使用人ES細胞對PD實施臨床試驗,京都大學的研究團隊在日本啟動了臨床試驗。要想使PD的細胞治療實現標準化,共享非臨床試驗和臨床試驗的結果至關重要。在細胞移植治療中,移植的細胞有望在腦主記憶體活並作為多巴胺神經細胞工作,因此被認為需要進行嚴格的管理。這篇論文整理了為確認人源iPS細胞多巴胺神經祖細胞的安全性和有效性而實施的非臨床試驗的結果。
研究結果
1)來自人源iPS細胞的多巴胺神經祖細胞(DAP)製造工序(圖2)
研究團隊首先確立了製造臨床用細胞製劑的工序。採用通過HLA純合志願者供體在京都大學iPS細胞研究所建立的iPS細胞庫作為原料,製作了數百個主細胞庫(MCB)。計劃在為患者治療時,解凍1瓶MCB並分化誘導DAP,然後無需冷凍直接用於移植,非臨床試驗也利用同樣的方法解凍並分化誘導了25瓶MCB,確認了製造工序的再現性。分化誘導方法以此前開發的研究用分化誘導法為基礎,將試劑、抗體和細胞分選儀變更成了可以臨床使用的產品。
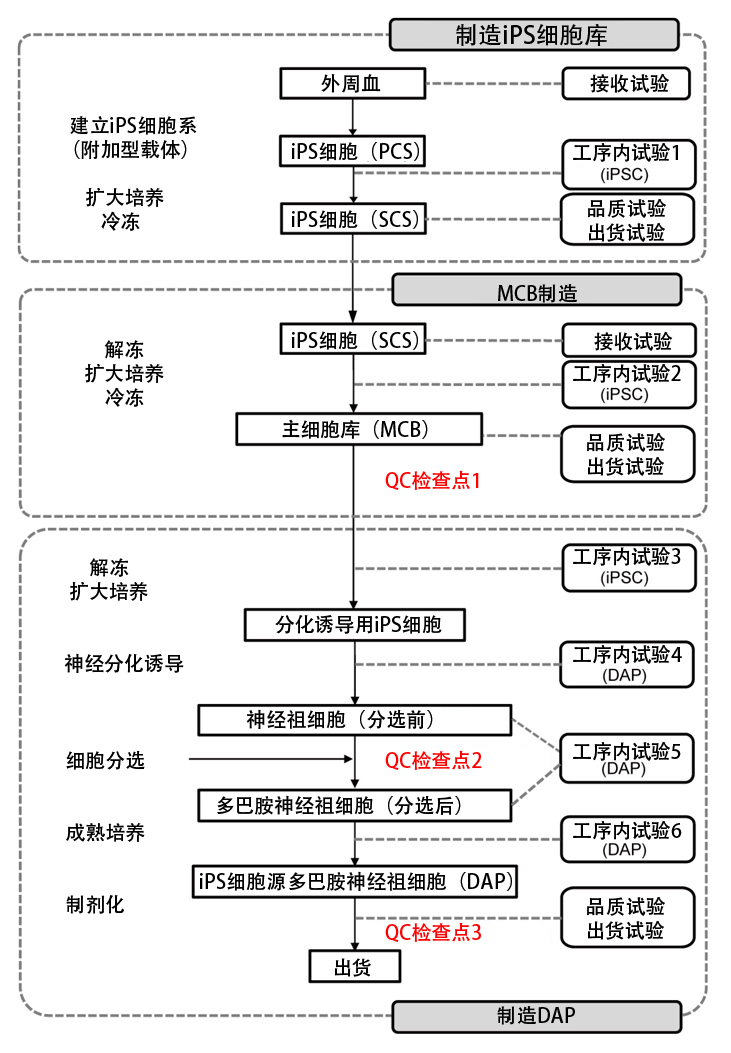
圖2:人源iPS細胞多巴胺神經祖細胞(DAP)的製造工序
2)iPS細胞及最終產物的特性評估(圖3)
作為分化誘導工序中的品質評估,設定了3個檢查點(iPS細胞、細胞分選前後、最終產物)。首先,關於iPS細胞(MCB003)的品質評估,確認了群集形態以及TRA-1-60、TRA-2-49和SSEA-4等未分化細胞標誌物,還確認了無菌性。DAP實施了25次分化誘導,在實施分化誘導第12天的細胞分選前後確認,分化標誌物(CORIN)和未分化標誌物(TRA-1-60)的表達量分別為10%以上和0.1%以下。關於最終產物的品質管理,在分化誘導第26天通過流式細胞術和定量PCR確認,DAP(FOXA2+TUJ1+)為主體(80%以上),不含未分化細胞(未分化iPS細胞:OCT3/4、TRA-2-49、LIN28、未分化神經幹細胞:SOX1+PAX6+細胞)。另外,還通過測量釋放到培養基中的多巴胺的量以及對自發動作電位進行電生理學解析確認,DAP分化為功能成熟的多巴胺神經細胞。
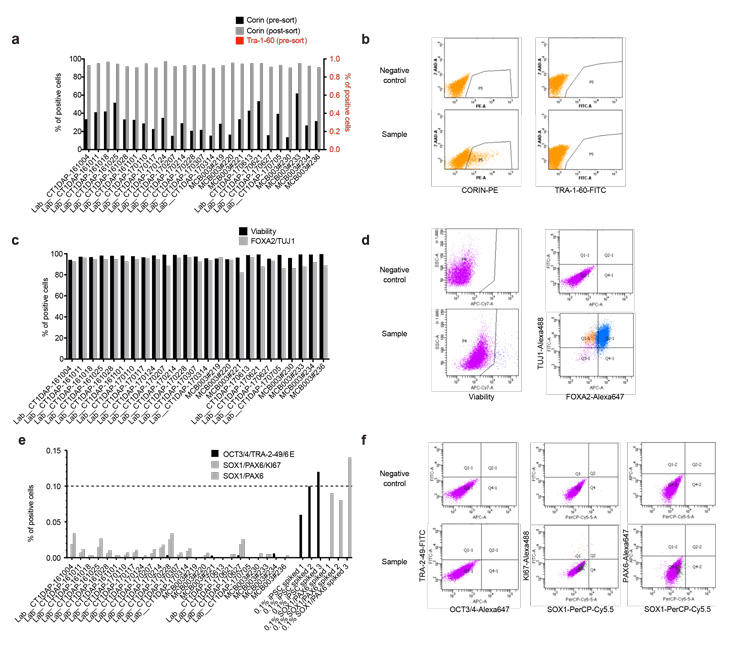
圖3:基於流式細胞術的特性解析結果
a,b)實施分化誘導第12天的分化標誌物和未分化細胞標誌物的表達解析結果。c,d)實施分化誘導第26天的細胞存活率(Viability)及分化標誌物(FOXA2/TUJ1)的表達解析結果。e,f)實施分化誘導第26天的未分化iPS細胞標誌物(OCT3/4、 TRA-2-49/6E)及增殖性神經幹細胞標誌物(SOX1、PAX6、KI67)的表達解析結果。
3)基因體和表觀基因體解析、單細胞解析(圖4)
細胞製劑的基因體和表觀基因體突變可能會影響移植後的細胞動作,因此評估了製造工序中的基因體和表觀基因體的穩定性。研究團隊實施6次分化誘導,對各iPS細胞以及分化誘導第12天和第26天的樣本實施了全基因體解析(whole genome sequencing: WGS)及外顯子組解析(whole exome sequencing: WES),並與培養iPS細胞的外周血細胞進行了比較。
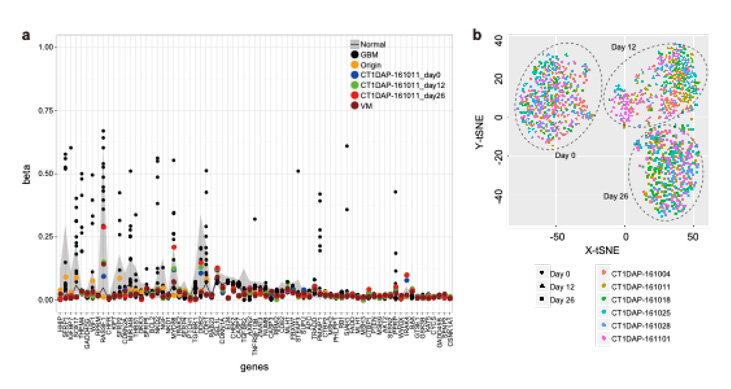
圖4:a)甲基化解析結果及b)單細胞表達解析結果
GBM:glioblastoma multiforme 多態性膠質母細胞瘤,Origin:外周血單個核細胞(iPS細胞的原料),CT1-DAP:多巴胺神經祖細胞,VM:胎兒中腦腹側組織
在基因體解析中未檢測出癌症相關基因發生突變,在73個基因的甲基化解析中確認,與惡性腦腫瘤相比,甲基化水平較低,與胎兒組織和正常細胞為同等水平。
為確認細胞製造工序的再現性,研究團隊對通過6次分化誘導製造的細胞的單細胞表達進行了解析。由此確認,通過6次分化誘導製造的細胞群顯示出相同的分佈,與多巴胺神經分化有關的基因表現在6次製造中均相同。
4)一般毒性及致瘤性試驗的結果(圖5)
研究團隊利用與用於基因體和表觀基因體解析的細胞相同的細胞,在GLP設施實施了一般毒性和體內分佈試驗及致瘤性試驗。與醫藥品醫療機器綜合機構(PMDA)進行討論後,決定將觀察期定為免疫缺陷小鼠(NOG小鼠)的存活期間,計劃對至少10隻小鼠進行組織學評估,並為80隻小鼠(對照組:50隻)移植iPS細胞。移植52周後,由於壽命原因,對照組的雄性小鼠減少至19隻,因此結束觀察,並進行了組織學評估。利用蘇木醇-伊紅(H-E)染色法未見組織學惡性發現和增殖圖像,確認多巴胺神經細胞順利存活。根據這些結果,可以認為細胞製劑沒有致瘤性。另外,接受移植的動物未發現因細胞移植而引起的異常,人源細胞僅存在於腦内,未發現向其他器官轉移。
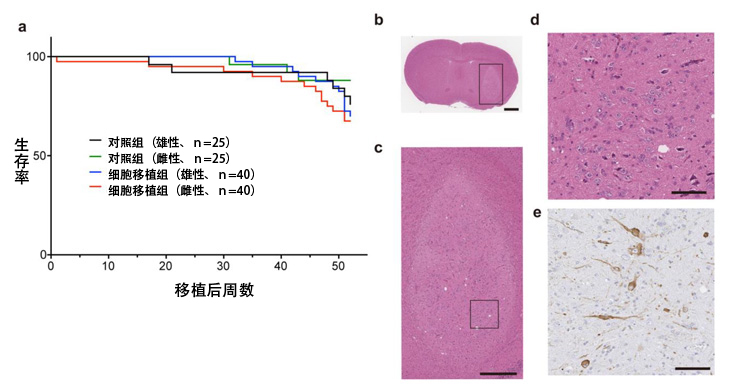
圖5:致瘤性試驗結果
a)免疫缺陷小鼠的存活曲線。b-d)實施細胞移植的小鼠腦剖切的H-E染色,e)TH(酪胺酸羥化酶、多巴胺神經標誌物)的免疫染色圖像。
為檢測混入的未分化iPS細胞,研究團隊向NOG小鼠皮下移植了包埋在基質膠中的最終產物,以及在最終產物中添加了0.001~10%的未分化iPS細胞的細胞(對照組)。作為陽性對照組的HeLa細胞和其他iPS細胞系形成了皮下腫瘤,而最終產物及添加未分化iPS細胞的對照組均未形成皮下腫瘤,確認產品中未混入未分化的iPS細胞,而且即使混入也不會形成腫瘤。
5)有效性試驗的結果
為確認有效性,向利用6-OHDA(6-羥基多巴胺,6-hydroxydopamine)使單側多巴胺神經細胞脫落的PD模型大鼠移植了最終產物。移植後16周,冰毒給藥後異常旋轉運動恢復正常,在紋狀體内確認多巴胺神經細胞成功存活,神經突起伸展。
研究意義與今後的課題
通過此次研究確認了來人源iPS細胞的多巴胺神經祖細胞的安全性和有效性。根據該結果,得到了PMDA及京都大學醫學部附屬醫院臨床試驗審查委員會的批准,在京都大學醫學部附屬醫院啟動了由醫生主導的臨床試驗(針對帕金森症,來自人源iPS細胞的多巴胺神經祖細胞的細胞移植安全性和有效性醫生主導臨床試驗,第I/II期)。關於富潛能幹細胞源細胞製劑的非臨床試驗,尤其是致瘤性試驗計劃和基因體解析的利弊,意見尚未達成一致,通過積累此次這種非臨床試驗的結果,有望推進試驗標準化的討論。
論文資訊
題目:Pre-clinical study of induced pluripotent stem cell-derived dopaminergic progenitor cells for Parkinson's disease
期刊:《Nature Communications》
URL:nature.com/articles/s41467-020-17165-w
文:JST客觀日本編輯部














