正電子發射型計算機斷層顯像(Positron Emission Computed Tomography,簡稱PET)是核醫學領域比較先進的顯像手段。其在腫瘤和中樞疾病診斷方面發揮著極其重要的作用。由於PET成像可以提供三維的,全身的,動態的圖像,與組織活檢相比,PET顯像結果更能真實的回饋腫瘤微環境的整體情況。因此,PET已經被廣泛用於臨床病人的診斷和篩選。但是,目前應用於腫瘤顯像的正電子藥物相當有限,開發新型的正電子藥物,是該領域重要的任務之一。近日,日本國立研究法人量子科學技術研發機構國立放射線醫學綜合研究所先進核醫學部張明榮教授課題組,在開發新型的多肽正電子藥物方法上有了新的突破,其課題組胡寬博士研究員等人基於蛋白蛋白相輔作用靶點,提出了一種「基於界面肽的PET藥物」開發理論,並首先在程序性死亡接受者(PD-1)/程序性死亡接受者配體1(PD-L1)靶點對中驗證了該方法的可行性(如圖1)。
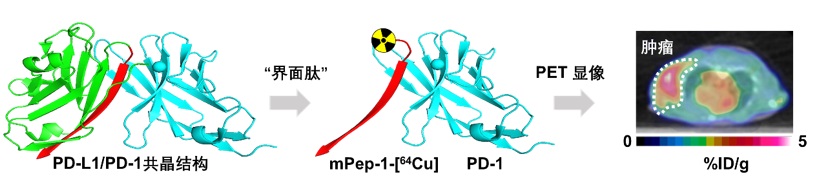
圖一:利用「界面肽」策略設計靶向程序性死亡接受者1(PD-1)的多肽正電子顯像藥物。第一步:對PD-1/PD-L1的共晶結構進行分析,找到合適的界面肽序列。第二步:對界面肽進行核素標記,穩定性研究和體外研究。第三步:在模型老鼠中研究「界面肽」的腫瘤歸巢能力以及藥動代力學數據。
研究背景
眾所周知,多肽藥物由於其良好的靶點獨特性,優良的體內藥代動機械性質,被認為是腫瘤核醫學顯像領域最有前景的一類分子。目前,已有多種多肽(類肽)正電子藥物廣泛應用於臨床研究,如68Ga-DOTATATE, 68Ga-PSMA-617等。儘管在過去的近二十年,多肽正電子藥物取得了巨大的進展,但是,全新的多肽正電子藥物鮮有出現。究其原因,主要來自於缺乏尋找先導多肽的有力的方法。儘管基於高通量篩選的方法,如噬菌體展示,RNA展示,晶片技術等方法,可以從龐大的多肽庫裏面找到高獨特性的結合靶點蛋白的多肽(2018年英國科學家Gregory P. Winter爵士因多肽和抗體的噬菌體展示技術而分享了2018年的諾貝爾化學獎)。該方法雖然十分有效,但是,耗費的時間和週期較長。更為重要的是,對於某些靶點,並不適用於高通量篩選,這就要求有其他有效的方法快速尋找多肽先導分子。
過去的數十年,科學家主要將注意力集中在癌細胞表面的接受者和抗原等,因此,在開發針對這些靶點的多肽核素藥物時,人們最先想到這些分子的内源性配體(圖二A)。通過對配體進行改造和標記,可以得到一些效果優異的顯像分子。但是,對於許多的生物標誌物,尤其是細胞内的蛋白,他們往往缺乏内源性的配體,取而代之的是與之相輔作用的蛋白質,這些相輔作用構成了一個龐大的蛋白互作網路。目前已知人體內有超過30萬對蛋白相輔作用,他們參與調控細胞的生老病死。當特定的蛋白互作偏差正常軌道,就會引發疾病。因此,通過外源分子調控異常的蛋白質互作,成為了癌症治療領域重要的方向之一。同時,這些異常的蛋白互作,也有潛力成為新的生物標誌物。
蛋白蛋白相輔作用(protein-protein interactions, PPIs)是由一段或者幾段多肽介導的,這些多肽被稱之為「界面肽」。人工合成界面肽可以一定程度上保留對互作蛋白的親合力和獨特性,因此,界面肽被已經廣泛應用於PPI抑制劑的開發。但是,界面肽是否能夠用於正電子顯像領域,還未有相關研究進行探索(圖二B)。
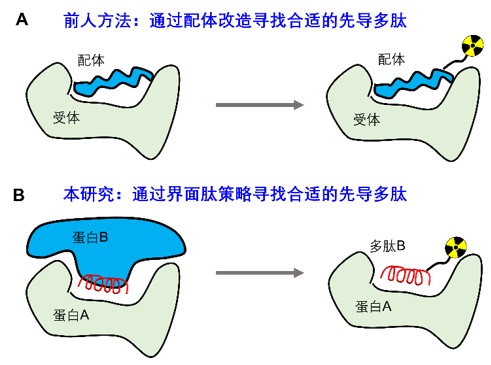
圖二:兩種不同的用於正電子顯像的先導多肽開發策略。(A)癌細胞表面某些接受者會獨特性高表達,其内生的配體或類似物可以用於接受者靶向的正電子顯像。如血管內皮成長因子(VEGF)靶向血管內皮成長因子接受者(VEGFR);(B)蛋白蛋白相輔作用通常由一段或者幾段關鍵多肽介導。通過對這些序列進行分析,可以得到一系列界面肽,這些多肽可以作為靶點識別肽的先導化合物。
研究内容
在本研究中,作者選取了PD-L1/PD-1這一對經典的蛋白相輔作用,作為概念研究對象。通過對PD-1/PD-L1的共晶結構進行分析,作者發現人的PD-L1/PD-1 和 老鼠的PD-L1/PD-1的晶體結構具有極大的相似性,其中界面肽部分,PD-L1與PD-1結合的關鍵序列為120-131多肽,在老鼠和人中,只有V128L這一個氨基酸不同。因此,作者選取了這一段序列作為先導多肽,同時保留了這一個氨基酸的差異,合成了兩條多肽,hPep-1和mPep-1。如圖三所示。
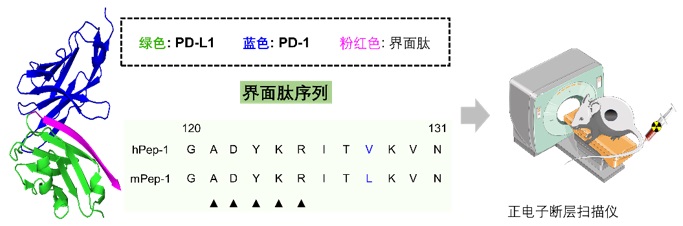
圖三:通過分析PD-L1與PD-1共晶結構,認為來自PD-L1的界面肽hPep-1(人源的多肽)和mPep-1(鼠源多肽)可以作為靶向PD-1的多肽先導化合物。進而利用先導多肽對老鼠腫瘤進行PET顯像。
接下來作者對這兩條多肽進行了核素64Cu標記,並對標記後的穩定性進行了考察。兩種多肽藥物在鼠血清中表現出較強的穩定性,孵育1小時,未觀察到明顯的多肽降解和64Cu解離。接下來,作者對這兩種藥物進行了體內成像研究。選取了負載鼠黑色素瘤B16F10的老鼠作為研究模型,該模型保留了老鼠的完整的免疫系統,在腫瘤微環境中,具有大量浸潤性的淋巴細胞。因此,該模型是一個非常適合PD-1PET顯像的模型。顯像結果如圖四所示。在通過微靜脈注射藥物之後20分鐘,觀察到mPep-1-[64Cu]在腫瘤中的大量攝取,但是hPep-1-[64Cu]在腫瘤中的攝取明顯低一些。在注射後40分鐘,同樣觀察到了類似的顯像。通過對PET圖像進行定量分析,我們發現mPep-1-[64Cu]在腫瘤和脾臟中的攝取和停留時間要明顯高於hPep-1-[64Cu],這也意味著mPep-1-[64Cu]是更好的靶向PD-1的PET顯像分子。接下來,作者通過改變腫瘤移植的位置,同樣觀察到了類似的現象。但是在免疫缺陷老鼠中,兩種多肽都不能對腫瘤進行顯像。
作者進一步通過體外分佈實驗,驗證了上述結果,並明確mPep-1-[64Cu]在腫瘤中的攝取為hPep-1-[64Cu]的1.5-2倍。為了證明mPep-1-[64Cu]為獨特性結合PD-1,作者還進行了體外放射線自顯影實驗。通過上述結果,明確的表明了mPep-1-[64Cu]是靶向PD-1的有效的多肽顯像分子。
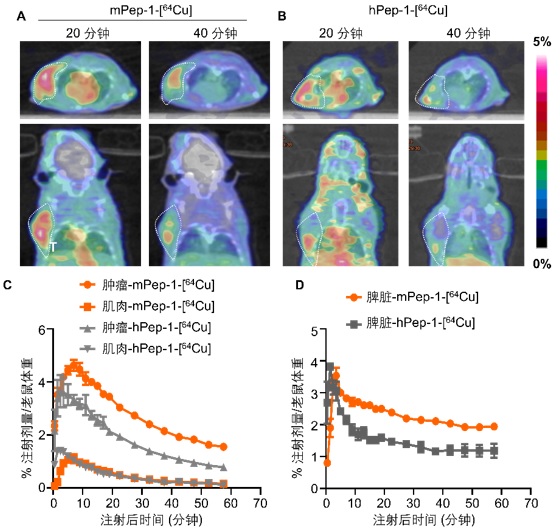
圖四:(A) mPep-1-[64Cu]以及hPep-1-[64Cu]在鼠黑色素瘤B16F10中的顯像結果。尾靜脈注射(A)mPep-1-[64Cu]和(B)hPep-1-[64Cu]後20分鐘和40分鐘,腫瘤中正電子藥物的富集情況。通過PET圖像,對腫瘤和肌肉(C)和脾臟(D)進行時間-放射活性關係動態統計分析。
由於hPep-1和mPep-1只有一個氨基酸的差別,但是他們的顯像性能差異明顯。這引發了作者的興趣。為了探討hPep-1和mPep-1發生差異的原因,作者測試了兩種多肽對B16F10細胞的結合能力。結構表明,mPep-1具有更高的細胞結合能力,其EC50 (53.88±3.37 nM)約為hPep-1-DOTA (EC50 = 170.40±3.39 nM)的三分之一。為了釐清多肽結合能力差異的原因,作者對這兩種多肽的結構進行了模擬,結果表明,兩種多肽的N端表現出類似的螺旋組態,然而,C端的結構明顯不同,hPep-1具有類似beta摺疊的結構,然而,mPep-1的N端更像是無規捲曲(圖五)。
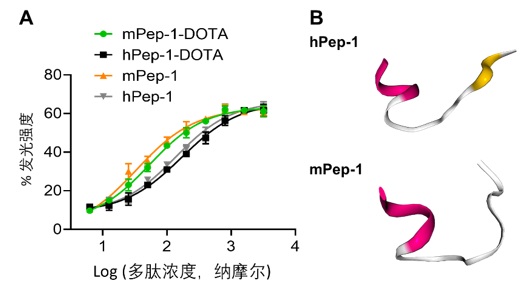
圖五:(A)螢光酵素法測試多肽與PD-1結合能力。(B)通過線上工具PEP-FOLD3.5對多肽mPep-1以及hPep-1的結構進行預測。
研究結果
通過上述實驗,作者證明了界面肽可以作為靶向蛋白蛋白相輔作用靶點的正電子藥物的先導化合物。同時,利用PD-L1/PD-1這一模型,作者首次開發了成像PD-1的多肽PET藥物。值得一提的是,通過觀察hPep-1和mPep-1的差異,作者也重點強調了在利用界面肽設計先導化合物時,應該考慮種屬差異。最後,作者認為PET顯像作為伴隨診斷的工具,為多肽藥物開發提供了新的評價手段。
未來展望
由於PPIs種類繁多,而且很多都可以成為癌症檢測的生物標誌物和治療的靶點。因此,未來,開發靶向PPIs的PET藥物意義重大。該研究提出的界面肽策略可以極大的促進該領域的發展。未來,作者也將在不同的靶點中實務該方法的有效性和普適性。
論文資訊
題目: Harnessing the PD-L1 interface peptide for positron emission tomography imaging of the PD-1 immune checkpoint
雜誌 RSC Chemical Biology
DOI 10.1039/D0CB00070A
文 胡寬(國立研究開發法人 量子科學技術研究開發機構)
編輯:JST 客觀日本編輯部













