大阪大學研究生院醫學系研究科的長野清一副教授(神經内科學)及日本國立精神和神經醫療研究中心(NCNP)神經研究所疾病研究第五部的荒木敏之部長等人組成的研究團隊發現,與肌萎縮性側索硬化症(ALS)和額顳葉變性(FTLD)發病有關的蛋白質TDP-43會調節核糖體在神經細胞軸突局部的蛋白質合成功能。另外還發現,該軸突的功能障礙可能與ALS和FTLD的發病有關。另外,吉林大學中日聯誼醫院神經内科的Yinshi Jin也參加了此項研究。
ALS和FTLD分別是因運動神經和大腦皮層神經受損而引起全身肌肉無力、肌肉萎縮以及癡呆症的神經疾病。研究發現,這兩種疾病均存在名為TDP-43的蛋白質以神經細胞内為中心異常積累(沉積物)的現象。不過,此前一直不清楚TDP-43在神經細胞中是如何發揮作用的,以及TDP-43沉積物是如何引起ALS和FTLD的。
TDP-43具有與傳訊RNA(mRNA)結合的特性,研究顯示,TDP-43會與大量mRNA結合併促進其在細胞内的成熟和轉運。此次,研究團隊著眼於神經細胞的軸突,作為通過TDP-43轉運到軸突的重要mRNA,確定了編碼核糖體蛋白的mRNA(核糖體蛋白mRNA)。研究發現,TDP-43通過將核糖體蛋白mRNA轉運至軸突,能維持軸突產生的核糖體蛋白的量,而這能維持在軸突中合成各種蛋白質所需的核糖體的數量,從而保持神經細胞的形態和功能(圖1)。
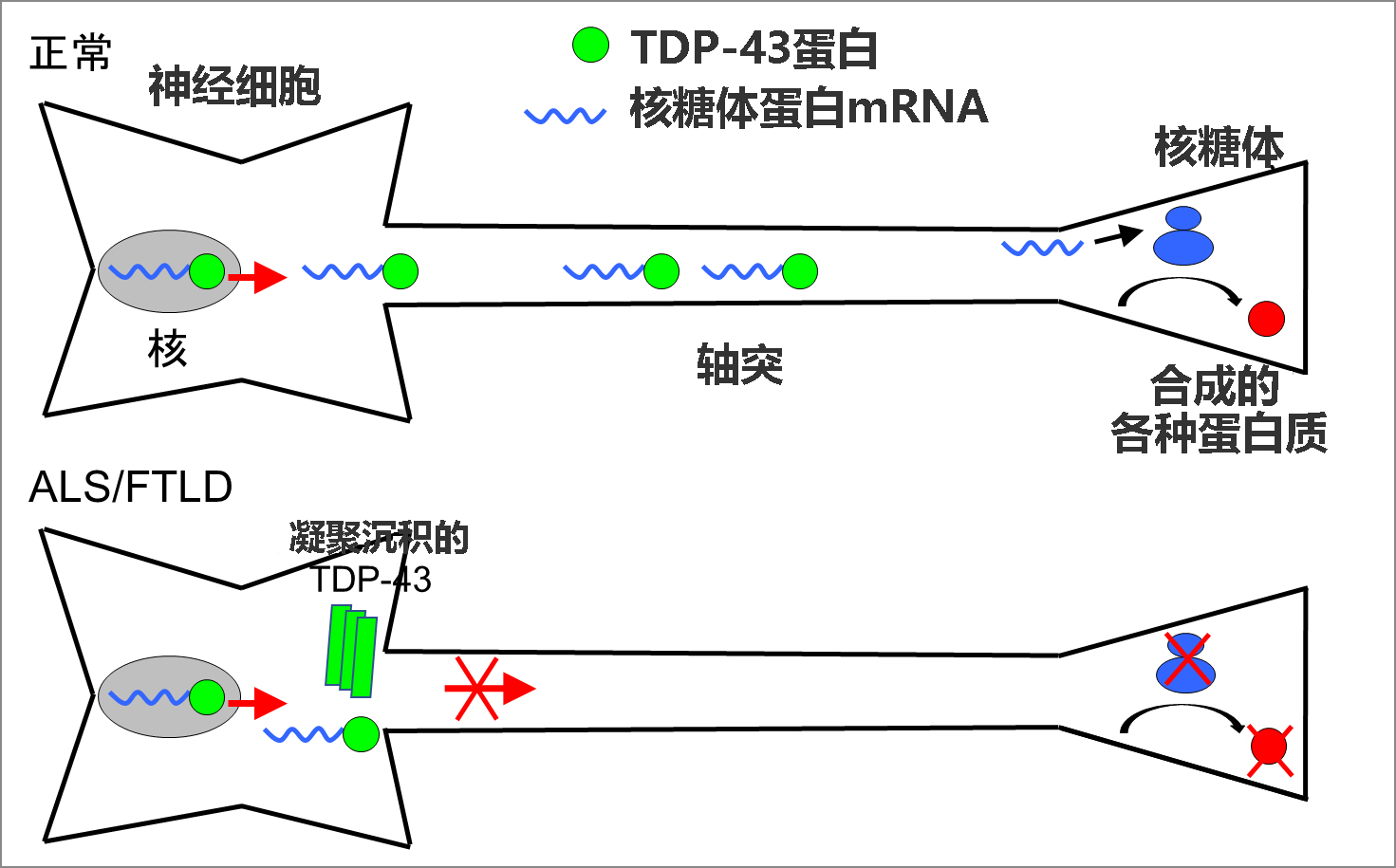
圖1:TDP-43的異常沉積物引起的ALS和FTLD的病理模型
該研究團隊認為,TDP-43在神經細胞内的異常沉積物,可能導致無法形成正常的RNA顆粒,因此無法將所需的mRNA轉運至神經突起,尤其是長神經突起——軸突,這可能會引起神經細胞傷害,從而引發ALS和FTLD,因此探索了通過TDP-43轉運至軸突的mRNA。
核糖體蛋白是構成核糖體、即通過mRNA產生蛋白質所必須的細胞内合成裝置的蛋白質,會大大影響核糖體對蛋白質整體的翻譯效率。研究團隊將核糖體蛋白的mRNA用於培養神經細胞並進行詳細解析發現,核糖體蛋白mRNA在軸突内以顆粒狀存在於與TDP-43相同的位置,核糖體蛋白mRNA與TDP-43會相互結合,隨著TDP-43減少,向軸突轉運的含核糖體蛋白mRNA的顆粒也減少。另外還發現,轉運至軸突的核糖體蛋白mRNA通過刺激神經細胞,在軸突内被翻譯成核糖體蛋白,為維持核糖體的翻譯功能發揮了重要作用。
研究團隊還確認,使培養的神經細胞和小鼠腦内的神經細胞中的TDP-43減少後,軸突的生長會逐漸惡化,但同時使多種核糖體蛋白mRNA過度表達時,隨著核糖體蛋白的恢復,軸突的生長得到改善(圖2)。此外,還在TDP-43異常沉積物的ALS患者的腦組織中,調查了主要是運動神經軸突在運行的部位,發現多種核糖體蛋白mRNA減少。
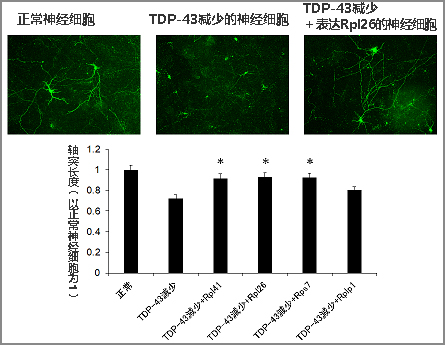
圖2:核糖體蛋白mRNA對TDP-43減少的神經細胞中發生的軸突生長障礙的改善效果
使小鼠大腦皮層神經細胞中的TDP-43減少後,抑制了軸突的生長,但此時使4種不同的核糖體蛋白(Rp)mRNA分別過表達發現,其中3種(帶*記號的)明顯改善了軸突的生長。
論文資訊
題目:「TDP-43 transports ribosomal protein mRNA to regulate axonal local translation in neuronal axons.」
期刊:Acta Neuropathologica
URL:link.springer.com/article/10.1007/s00401-020-02205-y
文:JST客觀日本編輯部














