本文及圖片均摘抄編譯自順天堂大學的研究成果公關發布資料
日本順天堂大學的奧村康特任教授和内田浩一郎副教授主導的研究團隊,向獨立行政法人醫藥品醫療機器綜合機構(PMDA)提交了實施「評估誘導型抑制性T細胞(以下簡稱JB-101)在活體肝移植中的免疫耐受誘導能力及安全性的I/II期臨床試驗」申請,將啟動由醫生主導的臨床試驗。
順天堂大學的研究團隊發現了選擇性地抑制對供體器官的免疫排斥反應的T淋巴細胞(JB-101),可長期誘導名為免疫耐受的非排斥狀態,並於2016年利用誘導型抑制性T細胞成功地讓肝移植患者完全脫離了免疫抑製劑。另外,2019年通過與順天堂大學創辦的新藥開發初創企業JUNTEN BIO開展聯合研究,還成功確立了穩定製造誘導型抑制性T細胞「JB-101」的方法。此次,順天堂大學將在日本移植學會的支持下,聯合東京女子醫科大學、廣島大學和長崎大學共同實施由醫生主導的評估JB-101的有效性和安全性的臨床試驗,以實現無需使用免疫抑製劑的肝移植療法。
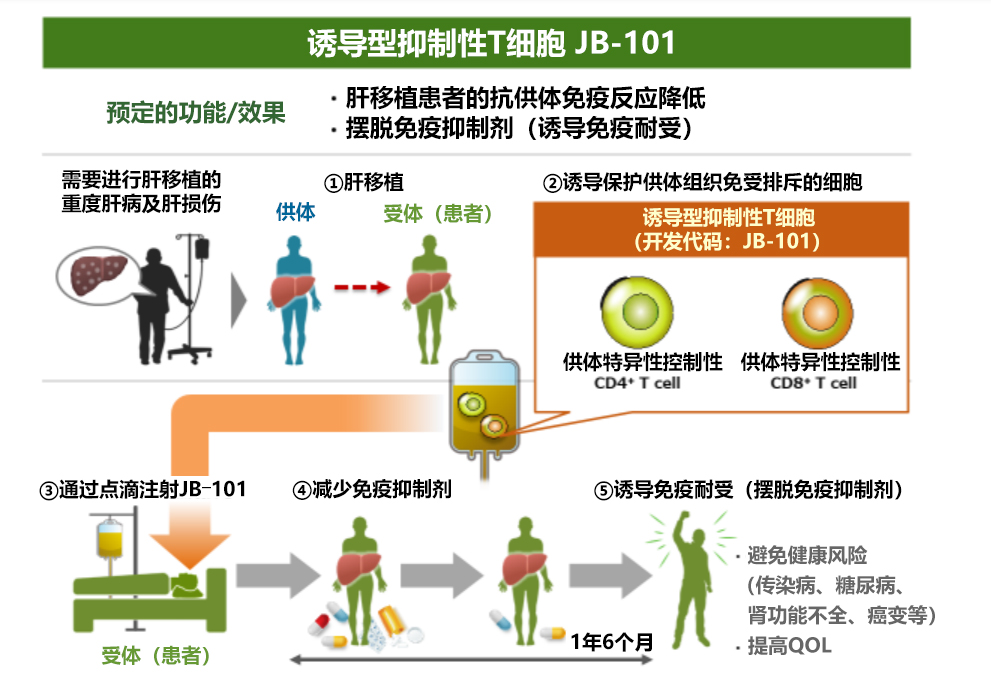
圖1:關於JB-101的免疫耐受誘導
臨床試驗概要
此次臨床試驗徵得患者同意後將在實施肝移植前的觀察期進行篩檢,以確認是否適合參加臨床試驗,然後利用單採術(Apheresis)在實施肝移植的14天前~3天前從供體、在實施肝移植的前一天從受試者體內採集外周血單核球。將從供體和受試者體內採集的白血球中的單核球與CD80/CD86抗體(激活T細胞的分子)進行共培養,培養的單核球會轉化成保護供體組織免受排斥的細胞(誘導型抑制性T細胞「JB-101」)。
作為注射JB-101的初步處理,為暫時減少體內的淋巴細胞,在實施肝移植後的第五天投用環磷酰胺。然後在實施肝移植10天或11天后為患者注射JB-101,利用約1年零6個月的時間慎重觀察是否會發生排斥反應,並逐漸減少免疫抑製劑的用量,最終徹底停用免疫抑製劑(擺脫免疫抑製劑)。
臨床試驗把擺脫免疫抑製劑超過1年以上的情況定義為「免疫耐受」,將評估JB-101的效果。臨床試驗的結果將提交給厚生勞動省進行審查。如果確認效果和安全性沒有問題,將作為再生醫療等的產品通過審批(計劃2026年内實現實用化)。該臨床試驗的目標是使順天堂及日本的再生醫療技術實現實用化,作為向全球推廣的第一步。
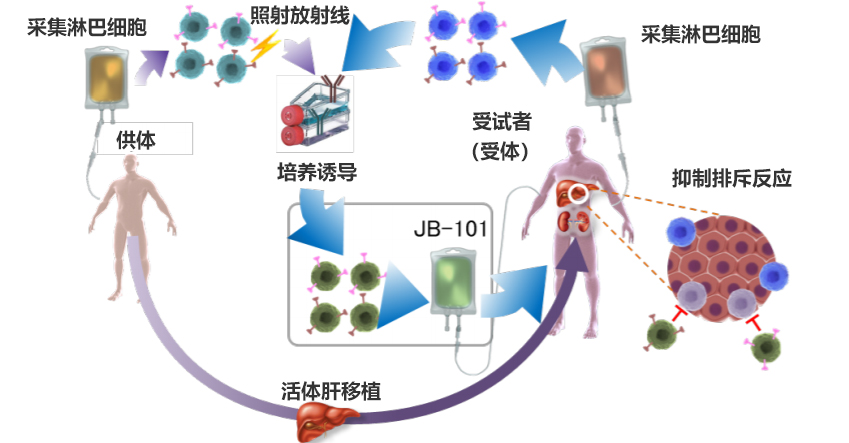
圖2:JB-101的製造流程
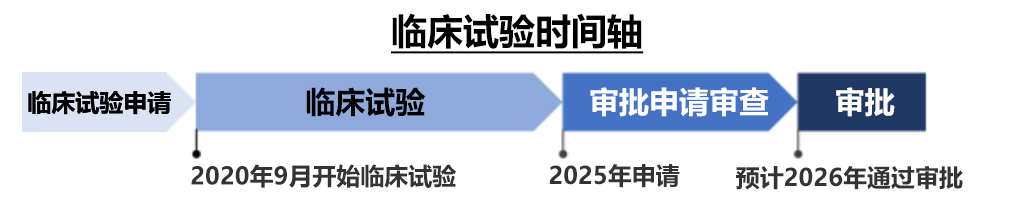
圖3:該臨床試驗的時間軸(目前的計劃)

圖4:該臨床試驗的實施體制
公關發布資料
編譯:JST客觀日本編輯部














