日本名古屋大學與醫藥基礎和健康營養研究所共同開發了針對胃癌等轉移形成的「腹膜種植性轉移癌」的候選治療藥物。該藥能抑制發生腹膜種植性轉移的胃癌細胞中大量存在的蛋白質的合成。在為小鼠給藥的實驗中,抑制了癌症的生長,延長了生存時間。今後將驗證安全性,以開展臨床試驗。

名古屋大學等正在開發針對難以治療的腹膜種植性轉移癌的藥物(圖片由神田光郎講師提供)
研究團隊由名古屋大學的小寺泰弘教授和神田光郎講師、以及醫藥基礎和健康營養研究所的小比賀聰特邀項目組長和笠原勇矢副項目組長組成。腹膜種植性轉移癌是胃癌和卵巢癌等轉移形成的。癌細胞像播種一樣散布在腹中,附著在袋狀腹膜的各個部位。
這些癌細胞開始形成團塊後,就會出現腹水和腸梗阻等症狀。很難將其完全清除,一般通過靜脈注射或服用抗癌藥治療,不過效果有限,經常會複發。
研究團隊發現,出現腹膜種植性轉移時,胃癌細胞中的「突觸結合蛋白13」在發生轉移之前就開始增加。在這種蛋白質較多的胃癌中,腹膜種植性轉移的發生率也比較高。
因此,研究團隊認為,抑制這種蛋白質的合成有望治療腹膜種植性轉移。因此開發了名為「反義核酸藥物」的候選治療藥,這種藥物可與參與蛋白質生產的傳訊RNA(核糖核酸)結合,促進其分解。
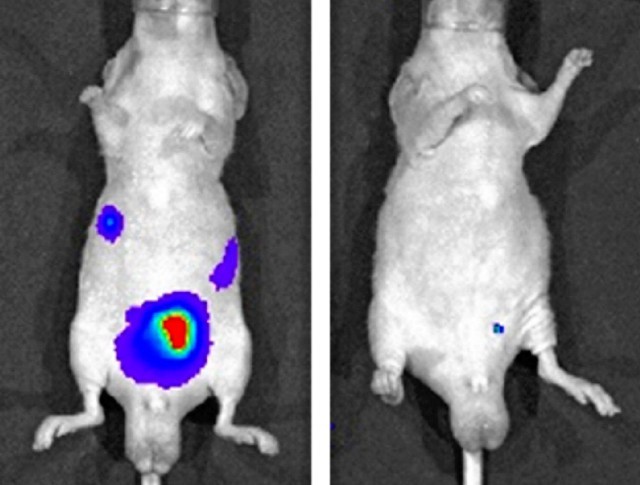
未進行治療的小鼠(左),癌細胞擴散到整個腹部。使用候選治療藥物的小鼠(右),抑制了癌細胞擴散(圖片由名古屋大學的神田光郎講師提供)
研究團隊製作了71種僅附著在特定傳訊RNA上的人工DNA。然後通過細胞實驗,選出2種可將突觸結合蛋白13的傳訊RNA的量減少90%以上的類型。注射到發生腹膜種植性轉移的小鼠腹部後確認,這兩種人工DNA均抑制了癌細胞擴散。癌細胞移植2個月後,未實施治療的小鼠有60%死亡,而使用候選藥物治療的小鼠全部存活下來。
研究團隊還通過其他實驗調查了是否存在降低肝功能的副作用。最終鎖定了一種未發現肝功能異常的人工DNA。
核酸藥物作為繼抗體等之後的又一種新型藥物備受關注。不過,這種藥物容易在體內分解,可能會與其他分子結合。在安全性和效果方面被指存在課題。此次為避免藥物立即在體內分解,增加了特殊的連接結構來穩定藥物。利用該技術的話,可以設計成容易配合靶分子的結構進行結合的狀態。另外,藥物被溶解在調節了鈣濃度的液體中,便於進入細胞。
今後將利用大鼠和猴子確認安全性。計劃2023年春季結束驗證,確認安全的話,將以發生腹膜種植性轉移的胃癌患者等為對象,推進臨床試驗,另外還打算應用於卵巢和胰臟等容易發生腹膜種植性轉移的器官的癌症。
日文:Slevin大浜華,《日經產業新聞》,2020年10月19日
中文:JST客觀日本編輯部













