本文根據金澤大學成果發布編譯整理而成
日本金澤大學奈米生命科學研究所的華山力成教授、研究生院醫藥保健學綜合研究科醫學專業醫學博士課程的Nguyen Tuan及宮竹佑治等人組成的研究團隊,確定了在癌症惡病質中導致脂肪組織減少的物質。
癌症惡病質是指隨著癌症惡化,患者的體重減輕並變得衰弱的現象,約80%的晚期癌症患者都會出現這種現象。癌症惡病質會引起各種問題,包括行走困難及抗癌藥治療效果減弱等,因此需要查清原因並開發預防方法。
此次研究團隊發現,癌細胞分泌的proliferin-1蛋白會作用於脂肪細胞,抑制脂肪生成並促進脂肪分解。研究團隊首先將各種癌細胞的培養上澄液添加到正在成熟的脂肪細胞中,篩選了抑制脂肪生成的培養上澄液(圖1)。
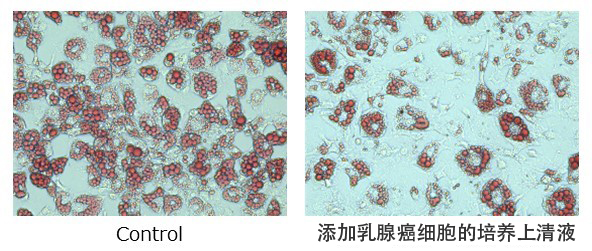
圖1: 利用癌細胞的培養上澄液抑制脂肪生成
利用紅色試劑檢測了正在成熟的脂肪細胞内儲存的脂肪。通過添加乳房癌細胞的培養上澄液進行培養,與對照組(Control)相比,明顯抑制了脂肪的生成。
接下來,通過分離並分析培養上澄液的成分,確定抑制脂肪生成的物質為proliferin-1。研究團隊將這種proliferin-1的重組體蛋白添加到正在成熟的脂肪細胞中確認,抑制了脂肪的生成(圖2)。另外,將proliferin-1添加到成熟後的脂肪細胞中發現,促進了儲存的脂肪分解。研究團隊向小鼠施用proliferin-1發現,這些作用導致了脂肪組織減少。此外還確認,向普通小鼠移植癌細胞的話,惡病質會引起脂肪組織減少,而proliferin-1缺損的癌細胞可以抑制脂肪組織減少。
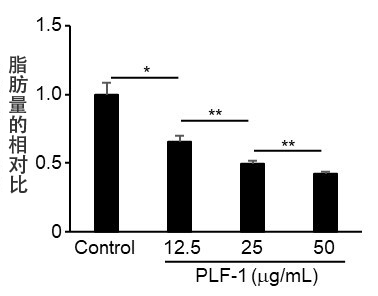
圖2:Proliferin-1抑制脂肪生成
向正在成熟的脂肪細胞中添加proliferin-1重組體蛋白並培養5天后,測量了儲存的脂肪量。圖中顯示了與未添加任何物質的對照組(Control)的相對比。(*p < 0.01; **p < 0.05)
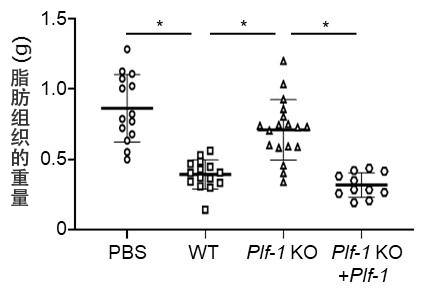
圖3:表達Proliferlin-1的癌細胞導致脂肪組織減少
向小鼠移植野生型(WT)癌細胞後,與未移植的對照組(PBS)相比,腸繫膜的脂肪組織重量減輕。而移植proliferin-1缺損的癌細胞(Plf-1 KO)則抑制了重量減輕,但重新表達proliferin-1後(Plf-1 KO + Plf-1),再次引起了脂肪組織減少。(*p < 0.01)
本研究表明,癌細胞釋放的proliferin-1在惡病質中會導致脂肪組織減少,抑制其作用有望改善癌症惡病質。今後有望將其作為改善癌症患者的生命質量(QOL)和預後的新治療靶點推進研究開發。
論文資訊
題目:Tumor‐secreted proliferin‐1 regulates adipogenesis and lipolysis in cachexia
期刊:International Journal of Cancer
URL:onlinelibrary.wiley.com/doi/10.1002/ijc.33418
日語發布資料
編譯:JST客觀日本編輯部














