日本大阪大學等組成的研究團隊日前宣佈,明確了大多數胃癌的致病原因——幽門螺桿菌(Helicobacter Pylori)持續感染胃部的機制。研究發現幽門螺桿菌能夠減少某種RNA(核糖核酸)的產生,從而使致癌因子的表達有所增加。該成果有望用於開發胃癌的診斷、預防及治療方法。
幽門螺桿菌顯微鏡照片(圖片:大阪大學微生物病研究所)
兒童時期胃部如果感染幽門螺桿菌,幾十年後會在病原性蛋白「CagA」的作用下引起萎縮性胃炎、胃潰瘍和胃癌等消化系統疾病。全球有一半的人口都感染了幽門螺桿菌。但與那些會被身體立即滅絕的病原細菌不同,幽門螺桿菌能長期持續感染胃部,而且一直不清楚與致癌因子之間的關係。此次,研究團隊從感染了幽門螺桿菌的小鼠和長爪沙鼠的胃部提取出幽門螺桿菌,對基因體等進行了分析。
研究發現,胃部感染幽門螺桿菌後,負責調節「HPnc4160」(一種RNA)生成的基因體序列「T重複序列」會發生基因突變,長度變長。由此HPnc4160的數量出現減少,CagA等毒力因子出現增加,從而使幽門螺桿菌容易長期感染胃部。人類胃癌患者的幽門螺桿菌也是如此,菌株導致T重複序列出現長短變化,這種變化有利於感染持續。
HPnc4160是一種「小RNA」,它與相當於蛋白質設計圖的「傳訊RNA」結合,幫助將遺傳資訊翻譯給蛋白質,但其自身並不被翻譯。
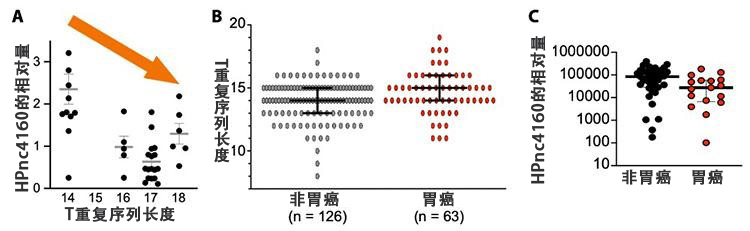
實驗結果。(A)從長爪沙鼠胃部提取的幽門螺桿菌的T重複序列變長,HPnc4160減少;(B)胃癌患者的幽門螺桿菌的T重複序列比沒有胃癌的人要長;(C)胃癌患者體內的HPnc4160較少(圖片由大阪大學微生物病研究所提供)
幽門螺桿菌會使其外膜蛋白定植在胃粘膜上。一系列的研究表明,HPnc4160會調節這種蛋白質和CagA的表達。
本次研究的研究成員之一、大阪大學微生物病研究所副教授三室仁美(病原微生物學)介紹說:「此次明確了幽門螺桿菌持續發生感染的基本機制。作為基礎研究意義重大。另外,有觀點指出,幽門螺桿菌的陽性患者如果大量使用抗生素來根除細菌,會產生耐藥菌增加的問題。因此,利用此次的成果還有望實現不滅絕幽門螺桿菌,而是抑制幽門螺桿菌的病原性的新治療方法。將來如果能通過調查T重複序列的長度和小RNA的表達確定治療的優先次序的話,應該還有助於削減醫療費用。」
本次的研究團隊由大阪大學、筑波大學、九州大學、大分大學、東京醫科齒科大學和東京大學的研究人員組成。相關成果已於日本時間4月9日發表在英國科學期刊《Nature Communications》上。
【論文資訊】
題目:A bacterial small RNA regulates the adaptation of Helicobacter pylori to the host environment
期刊:Nature Communications
URL:nature.com/articles/s41467-021-22317-7
日文:JST Science Portal 編輯部
中文:JST客觀日本編輯部














