名古屋大學研究生院醫學系研究科的清水大助教、小寺泰弘教授和松井佑介副教授、東京大學同位素綜合中心的谷上賢瑞特任副教授和秋光信佳教授、東京大學研究生院新領域創成科學研究科的波江野洋特任副教授以及九州大學醫院別府醫院外科的三森功士教授等人組成的研究團隊,通過全面分析DNA胞嘧啶中的約45萬個位置的甲基化狀態,成功製作了可以同時診斷和鑑別27種惡性腫瘤的甲基化面板。有望發展成可通過採血和驗尿等液體活檢準確識別惡性腫瘤位置的篩檢技術。相關研究成果已發布在Cancer Gene Therapy的電子版上。
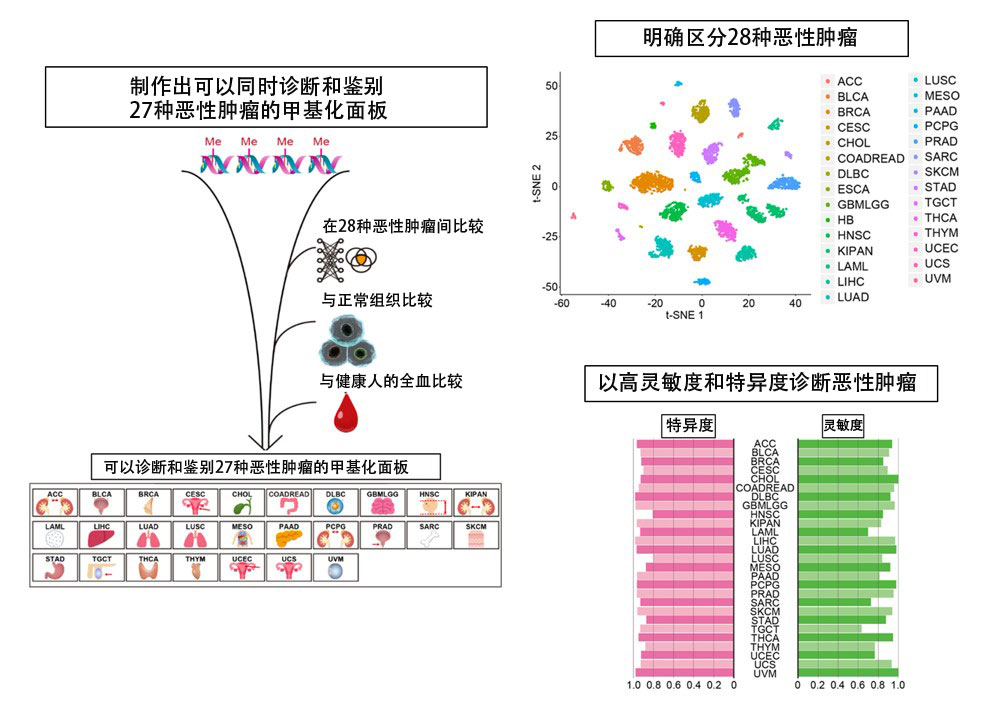
製作出可以同時診斷和鑑別27種惡性腫瘤的甲基化面板(供圖:名古屋大學)
近年來,從腫瘤穿透血液中的ctDNA作為惡性腫瘤的檢測對象備受關注。惡性腫瘤的存在,可以通過採血檢測血液中的惡性腫瘤中基因突變,就可以證明其存在。但幾乎所有發生在惡性腫瘤中的基因突變都是各種惡性腫瘤所共通的,因此即使通過檢測血液中的基因突變知道存在惡性腫瘤,也很難診斷其生長在哪個器官上。
研究團隊通過對公共數據庫中登記的28種惡性腫瘤共7950個病例的約45萬個位置的DNA甲基化數據進行比較分析,提取了其中27種惡性腫瘤分別特有的特徵性甲基化的胞嘧啶。另外,為了將範圍縮小到惡性腫瘤特有的異常甲基化上,與來自707個病例的正常組織DNA甲基化數據進行了比較,此外為了用於採血診斷,還與95例健康人的全血DNA甲基化數據進行了比較,最終製作了分析2572處DNA甲基化位點的甲基化面板。製作的甲基化面板能夠清晰地聚類和區分包括一種無法提取癌組織特徵性DNA甲基化位點的惡性腫瘤在内的28種惡性腫瘤。另外,研究團隊還把27種惡性腫瘤的病例分佈擬合為基於β分佈的機率密度曲線,並將假陽性和假陰性最小化的DNA甲基化值設為診斷惡性腫瘤存在的閾值,由此能以高靈敏度和特異度診斷27種惡性腫瘤。
研究團隊利用在自家設施獲得的樣本驗證了甲基化面板的診斷能力,針對乳房癌、大腸癌和胃癌的冷凍組織樣本,通過DNA甲基化陣列檢測調查了DNA甲基化狀態並應用於甲基化面板,確認幾乎所有樣本都能診斷為對應的惡性腫瘤。雖然製作甲基化面板使用的公共數據庫主要由歐美人的數據構成,實驗證實利用日本人的樣本也成功進行了診斷,這表明使用面板時可以不分種族。
研究團隊從公共數據庫獲取惡性腫瘤患者的血樣甲基化數據,驗證了面板能否應用於以ctDNA為對象的採血檢測。在利用健康人、乳房癌、大腸癌和肺癌患者的血樣進行的驗證中,健康人的假陽性率僅3.7%,而乳房癌和大腸癌的絕大多數病例都能診斷為對應的惡性腫瘤。另一方面,在肺癌病例的血樣中,由於血液中所含的ctDNA量較少,很難作為肺癌檢測出來,未來ctDNA甲基化分析技術的開發備受期待。
此外,研究團隊還利用原發竈不明的癌症患者的血液數據,驗證了能否利用甲基化診斷面板推測原發竈。結果顯示,利用甲基化診斷面板推測的原發竈與根據臨床病程預測的原發竈基本一致。
此次開發的DNA甲基化面板表明,主要利用腫瘤組織數據就可以鑑別和診斷27種惡性腫瘤。未來,如果ctDNA甲基化分析技術的開發取得進展,還能以更高的精度應用於血液檢測診斷。研究團隊旨在開發一種篩檢技術,可以通過一次採血診斷多達27種惡性腫瘤。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













