核心要點:
1. 表皮成長因子接受者酪胺酸激酶抑制劑(EGFR-TKI)是EGFR突變陽性的非小細胞肺癌(NSCLC)的一線治療藥物,但是,EGFR-TKI對EGFR野生型的NSCLC效果不佳。
2. 研究人員設計了一種多功能的奈米藥物,該奈米藥物以四氧化三鐵奈米顆粒(SPIO)為核心,同時負載厄洛替尼和貝伐單抗,實現了腫瘤内的選擇性富集。
3. 該奈米藥物在EGFR野生型的A549異種移植腫瘤小鼠模型中,成功抑制了腫瘤的生長,表明奈米藥物逆轉了A549腫瘤細胞對厄洛替尼的抗性。
4. 融合核磁共振造影技術,實現了對奈米藥物瘤内富集的動態監測;並且對腫瘤組織内血管的形態和力學變化進行了觀測。
國立研究開發法人量子科學技術研究開發機構量子生命・醫學部門量子醫科學研究所先進核醫學基礎研究部胡寬研究員,張明榮部長等人與中國暨南大學的研究人員合作,開發了一種新型的多功能奈米藥物用於逆轉表皮成長因子野生型非小細胞癌肺癌(EGFR-wt NSCLC)對酪胺酸激酶抑制劑(TKI)厄洛替尼的抗性,為具有野生型的EGFR非小細胞肺癌病人提供了一種潛在的治療方式。該成果於近日發表在重要的生物材料期刊《Bioactive Materials》。
研究背景
原發性肺癌是世界範圍内最常見的惡性腫瘤。從病理和治療角度,肺癌大致可以分為非小細胞肺癌(non small cell lung cancer,NSCLC)和小細胞肺癌(small cell lung cancer, SCLC)兩大類,其中非小細胞肺癌約佔比80-85%,小細胞肺癌約佔比15-20%。全球絕大多數國家,肺癌的發病率與死亡率均居首位。2018年全球新增肺癌患者209.4例,死亡176.1萬例,分別佔全部癌症發病與死亡的11.6%和18.4%。由此可見,開發針對肺癌的治療藥物迫在眉睫。
非小細胞肺癌的藥物治療包括化療、分子靶向治療以及免疫治療。研究發現,非小細胞肺癌中存在一些基因的突變或者表達異常,從而導致了腫瘤的發生。根據NCCN指南推薦目前非小細胞肺癌相關的基因突變有:EGFR基因突變、ALK基因重排、ROS1基因重排、BRAF點突變、KRAS突變、Met外顯子突變、RET重排、ERBB2基因突變等。根據這些基因的異常變化,針對非小細胞肺癌的分子靶向治療藥物相繼被開發出來。
EGFR、ALK和ROS1是非小細胞肺癌最主要的驅動基因,也是最具臨床價值的靶點,其中EGFR突變佔比高,成藥種類較多。目前研究表明,EGFR突變陽性的NSCLC, 應用EGFR-TKI單藥治療安全有效,其代表藥物厄洛替尼已經成為EGFR突變陽性NSCLC的標準一線治療方案,而對EGFR野生型的NSCLC,EGFR-TKI的治療效果欠佳。因此,如何提高厄洛替尼在EGFR-WT的NSCLC中的有效率,是重要的醫學問題。
研究内容
EGFR-TKI在EGFR野生型NSCLC中的療效欠佳的機制尚不清楚。但是,科學家嘗試了多種方式,來克服EGFR野生型NSCLC對TKI的抗性。比如科學家將組蛋白去乙醯化酶(HDAC)抑制劑Panobinostat或者自噬抑制劑Chloroquine 與厄洛替尼聯合使用,成功逆轉了EGFR-WT非小細胞肺癌對厄洛替尼的抗性。儘管這些方案取得了不錯的效果,但是這些方案存在著不足,未來臨床效果如何還有待進一步的檢驗。因此。開發新的可以逆轉EGFR-WT非小細胞肺癌對厄洛替尼抗性的方案具有重要的科學意義和應用價值。
該項目中,研究人員製備了一種由磁性奈米顆粒四氧化三鐵(SPIO)為核心的奈米藥物,在SPIO的表面,由聚乙二醇-磷酸酶分子(DSPE-PEG2000-COOH)形成一層保護膜,由於厄洛替尼的疏水性,其可以嵌入奈米顆粒的疏水内部,在奈米顆粒的表面,進一步修飾了一種靶向血管表皮正常因子的單源抗體-貝伐單抗(Bevacizumab)。因此,該奈米藥物具有多種功能:首先,選擇性遞送厄洛替尼到腫瘤部位;其次,貝伐單抗可以提高靶向遞送的效率,而且促進腫瘤血管的正常化;SPIO是一種核磁共振造影試劑,通過監測SPIO的信號,可以即時追蹤奈米藥物在體內的動態(圖1)。
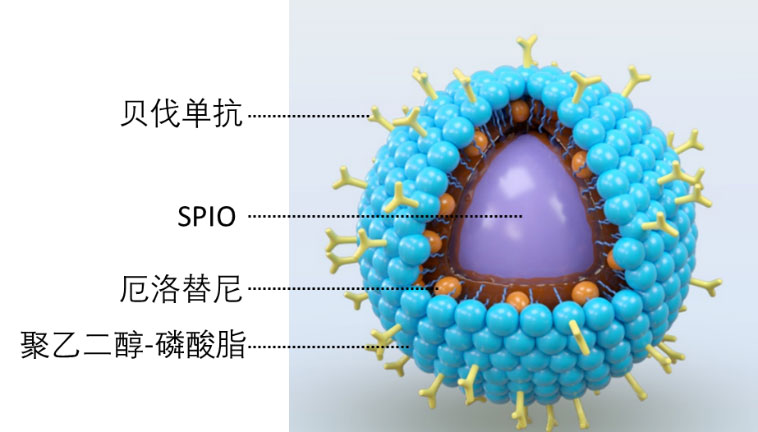
圖1. 奈米藥物的結構示意圖。
研究人員首先表徵了奈米藥物的形貌和物化參數。結合TEM和動態光散射表徵結果,得到奈米藥物的平均尺寸為28.3 nm。該奈米藥物具有良好的體外穩定性,在溶液中,表現出一定的表面負電位。隨後研究人員對奈米藥物的細胞毒性進行了研究。結果表明:與厄洛替尼單藥相比,奈米藥物對A549細胞的抑制效率顯著提升。機制研究表明,奈米藥物成功引起了細胞内活性氧(ROS)的產生,從而誘導了細胞的凋亡。
研究人員接下來通過核磁共振造影技術監測了奈米藥物的瘤内富集效率。結果表明,表面修飾了貝伐單抗的奈米顆粒具有更高的瘤内富集效率。奈米藥物在瘤内的富集在注射後12小時内達到峰值。隨後,研究人員在移植了A549腫瘤細胞的小鼠模型體內,測試了奈米藥物的治療效果。不出所料,奈米藥物完全逆轉了小鼠腫瘤的生長(圖2),且治療過程中,小鼠未表現出明顯的體重改變和血液指標的變化,表明奈米藥物具有良好的體內安全性。
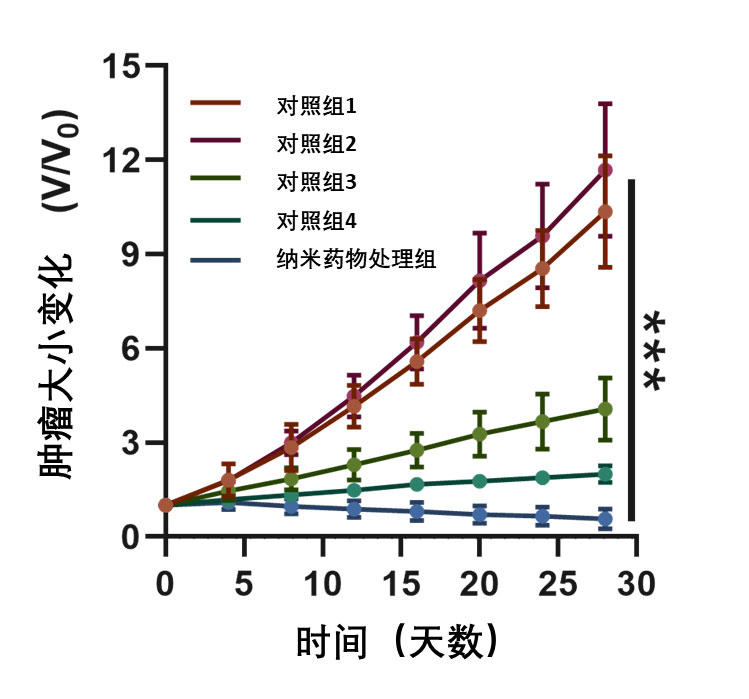
圖2. 實驗鼠腫瘤生長曲線。
為了詳細瞭解貝伐單抗的作用,作者通過功能核磁共振造影技術和組織免疫染色手段對腫瘤血管的組織形態、標誌物的表達等指標進行了表徵。在治療的終點,核磁共振造影顯示奈米藥物處理的小鼠具有最佳的腫瘤血管狀態,並且血管內水分子擴散以及血液灌注的指標都是最好的,表明貝伐單抗促進了血管正常化,防止了乏氧的產生,增強了厄洛替尼的效果(圖3)。
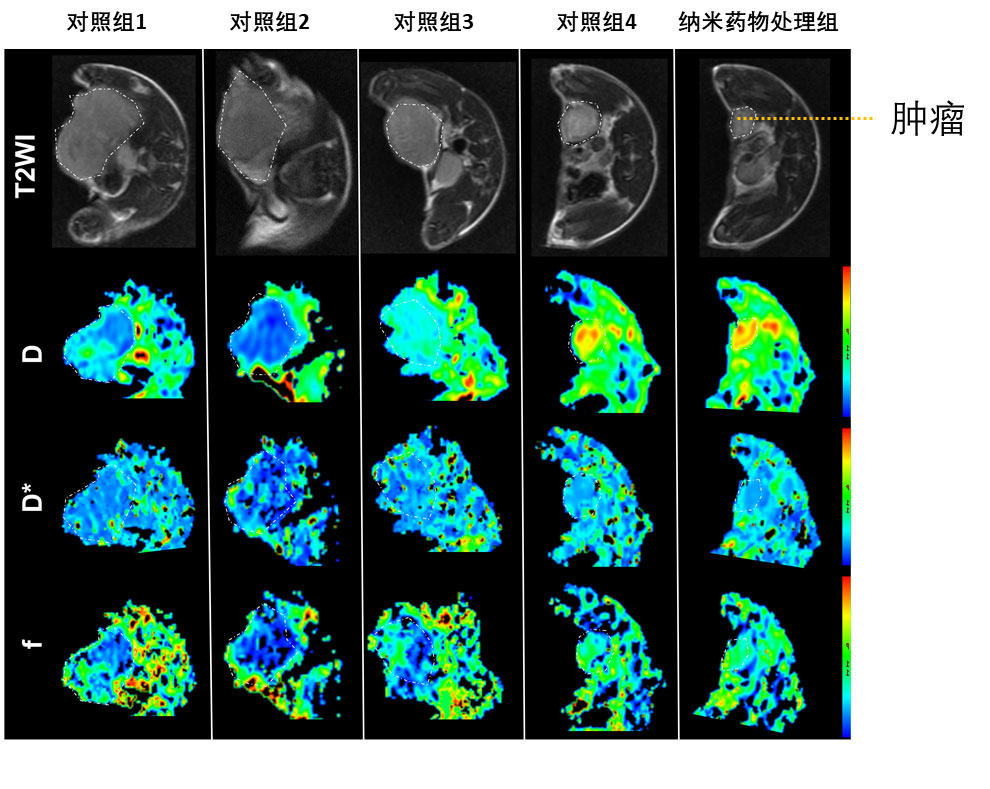
圖3. 功能核磁成像結果。
研究結論
研究人員成功開發了一種多功能的、診療一體化的奈米藥物,該奈米藥物可以靶向遞送厄洛替尼到達腫瘤部位,並且逆轉EGFR野生型NSCLC對厄洛替尼的抗性。此外,奈米顆粒表面的貝伐單抗進一步提高了奈米藥物的靶向遞送效率,並促進了腫瘤血管正常化,提高了厄洛替尼的治療效率。總之,該研究為EGFR野生型非小細胞肺癌提供了這一種全新的治療方案,具有極高的臨川轉化價值。
論文資訊
論文題目: A multifunctional nanotheranostic agent potentiates erlotinib to EGFR wild-type non-small cell lung cancer
刊載期刊 Bioactive Materials
論文鏈結:doi.org/10.1016/j.bioactmat.2021.10.046
文 胡寬
編輯修改 JST客觀日本













