石川 邦夫九州大學 研究生院齒學研究院 生物材料學領域 教授 |  |
■骨骼與碳酸磷灰石與水酸磷灰石
骨骼的成分是含有6〜9質量%碳酸基的碳酸磷灰石。但作為人造骨投入臨床應用的是不含碳酸基的水酸磷灰石(羥基磷灰石)。水酸磷灰石人造骨發明於1970年代,毫無疑問,這是一種具有骨傳導性(將材料植入骨缺損處後,在材料表面骨骼與其結合的特性)的劃時代材料。然而,水酸磷灰石人造骨的骨傳導性不如自體骨。另外,自體骨可以通過骨重塑(通過吸收舊骨的破骨細胞和形成新骨的成骨細胞,將舊骨更換為新骨的生物功能)被新骨更換,而水酸磷灰石人造骨不會被更換。因此,骨缺損重建術的首選是自體骨移植(從健康部位採集移植骨,移植到骨缺損部位)。
由於陶瓷粉末會引起結晶性發炎,如果作為人造骨進行臨床應用需要製成塊狀。研究發現,含碳酸基的碳酸磷灰石在燒製溫度下會發生熱分解,從磷灰石結構中除去羧基作用後,可以燒結成水酸磷灰石。另外,水酸磷灰石燒結體具有骨傳導性,由此作為人造骨實現了臨床應用,這就是水酸磷灰石人造骨的歷史。
然而,生物體不是通過燒結形成骨骼的,而是在存在水的體內形成骨骼。無脊椎動物選擇的骨骼成分是碳酸鈣,它可以由海水成分構成。生物體在演化過程中需要向體內儲存能量代謝所需的磷,因此選擇了在碳酸鈣中加入磷的碳酸磷灰石作為骨骼成分。筆者受演化的啟發,將碳酸鈣塊體浸入磷酸鹽水溶液中發現,其成分可以在保持形態不變的情況下變成碳酸磷灰石,因此命名為「溶解析出型」成分轉變【1】、【2】。
■骨成分為碳酸磷灰石的人造骨
當在碳酸磷灰石塊表面培養破骨細胞時,我們觀察到了與骨骼一樣的破骨細胞骨吸收陷窩。在水酸磷灰石表面未觀察到吸收陷窩。破骨細胞會形成Howship陷窩(骨吸收表面的吸收陷窩),將内部變為弱酸性並吸收骨骼。在生理環境(pH7.4)下,碳酸磷灰石是比水酸磷灰石更穩定的穩定相,但在弱酸性區域,穩定相會發生逆轉,碳酸磷灰石變得不如水酸磷灰石穩定,容易被溶解。利用人造骨重建實驗動物的骨缺損發現,相對於水酸磷灰石完全沒有被更換,而碳酸磷灰石在經過一段時候後完全被新骨所取代。另外,碳酸磷灰石人造骨與其他人造骨相比顯示出超高的骨傳導性(圖1)。
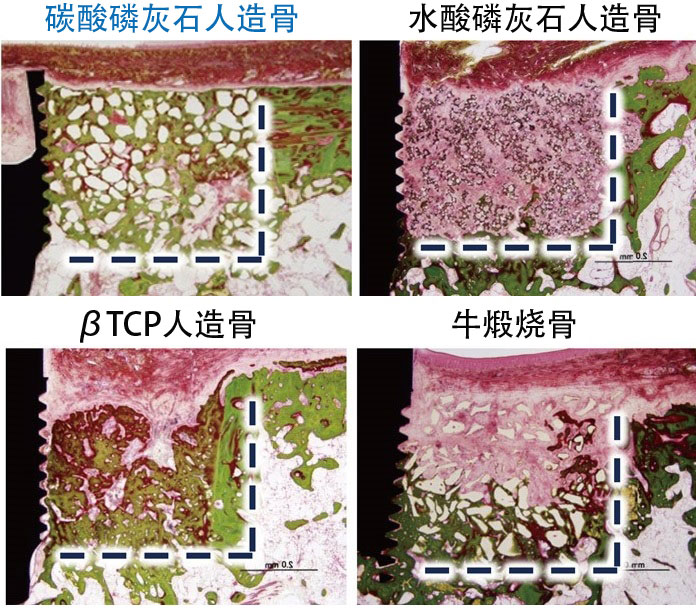
圖1:使用人造骨重建比格犬頜骨種植體旁邊的骨缺損,4周後的病理組織圖像(Villanueva Goldner染色,綠色為成熟骨)
在進行了包括使用模擬試驗(利用實驗動物確認醫療器械性能的試驗)在内的非臨床試驗後,我們在種植牙的前提下,實施了碳酸磷灰石人造骨用於上頜竇提升術實施的骨缺損重建的多設施臨床試驗。上頜竇提升術被歸類為兩階段的手術,可以在用碳酸磷灰石形成骨骼後再植入種植牙,因此可以進行活檢(活體組織檢查)。不僅在骨形成和種植體固定等所有評估項目均被證明100%有效,而且還驗證了碳酸磷灰石人造骨即使在人體內也能被新骨所替代【3】、【4】。
根據多設施臨床試驗的結果,碳酸磷灰石人造骨於2017年12月被藥事機構批准為全球首個骨成分為碳酸磷灰石的人造骨,並於2018年2月由日本最大的牙科材料企業GC以「Cytrans Granules」品名商品化。此前在日本,用於以種植牙為前提的骨重建術的人造骨和用於超負荷部位的人造骨一直未獲得過藥事批准。碳酸磷灰石人造骨是日本首個獲准用於以種植牙為前提的骨重建術和超負荷部位的骨重建術等所有牙科領域的人造骨。
■超越自體骨的碳酸磷灰石人造骨
如上所述,根據自體骨的成分發明的碳酸磷灰石人造骨,具有與自體骨不相上下的骨傳導性,但還未能超越自體骨。人造骨相對於自體骨的優勢是可以靈活控制其結構。因此,製備了具有三維連通孔或一維連通孔的碳酸磷灰石人造骨。三維連通孔結構是通過對用噴霧乾燥法製備的氧化鈣球進行處理,使其膨潤結合併碳酸化和磷酸化製備的。雖然機械強度還需要進一步改善,但由於是三維結構,植入4周内就會能被新骨更換。一維連通孔(蜂窩結構)結構的人造骨通過擠製成形法制備。具體來說,是通過將含碳酸鈣的粘合劑通過蜂窩模具擠壓,並進行去脂和磷酸化製備的。蜂窩結構擁有強烈的毛細管現象,在骨缺損部會瞬間吸收血液等。利用這種碳酸磷灰石蜂窩人造骨時,可以非常簡單地實現自體骨也難以重建的垂直型骨形成(例如,牙齒脫落後頜骨高度會變低。重建頜骨高度的術式等在無骨部位垂直形成骨骼的術式稱為垂直型骨形成)(圖2)【5】。
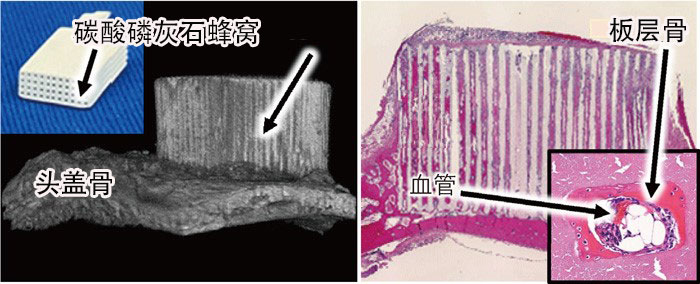
圖2:利用碳酸磷灰石蜂窩人造骨在兔子頭蓋骨上進行垂直骨再造
左:碳酸磷灰石蜂窩人造骨的照片與術後4周的微CT圖像
右:術後4周的病理組織圖像(蘇木醇-伊紅染色,紅色為成熟骨,方框内是垂直剖面的通孔放大圖)
包括使用3D列印機控制結構在内,碳酸磷灰石人造骨的結構可以自由控制。另外,人造骨的結構與成分都是決定骨再生的重要因素。今後的目標是推進碳酸磷灰石人造骨的結構控制,使性能遠遠高於自體骨的碳酸磷灰石人造骨獲得藥事批准。
參考文獻
【1】:Kunio Ishikawa: Bone substitute fabrication based on dissolution-precipitation reaction. Materials, 3, 1138-1155, 2010
【2】:Kunio Ishikawa: Carbonate apatite artificial bone. Science and Technology of Advanced Materials, 22(1), 683-694, 2021.
【3】:Kudoh K, Fukuda N, Kasugai S, Tachikawa N, Koyano K, Matsushita Y, Ogino Y, Ishikawa K, Miyamoto Y: Maxillary sinus floor augmentation using low-crystalline carbonate apatite granules with simultaneous implant installation: First-in-human clinical trial. J Oral Maxillo Sur, 77(5):985.e1-985.e11, 2019.
【4】:Nakagawa T, Fukuda N, Kasugai S, Tachikawa N, Koyano K, Matsushita Y, Sasaki M, Ishikawa K, Miyamoto Y: Application of low crystalline carbonate apatite granules in two-stage sinus floor augmentation: a prospective clinical trial and histomorphometric evaluation. J Periodont & Imp Sci, 49(6), 382-396, 2019.
【5】:Ishikawa K, Munar ML, Tsuru K, Miyamoto Y: Fabrication of carbonate apatite honeycomb and its tissue response. J Biomed Mater Res Part A, 107A:1014–1020, 2019.
原文:《產學官合作月刊》,2022年1月號
翻譯編輯:JST客觀日本編輯部














