京都大學研究生院生命科學研究科的井垣達吏教授和榎本將人助教組成的研究團隊通過使用果蠅研究發現了攜帶不同基因突變的良性腫瘤細胞彼此相鄰時會導致相互浸潤和轉移的現象,同時還闡明瞭發生這種現象的機制。這是首次闡明腫瘤内異質性導致癌症發展的機制,有望成為開發新的癌症治療藥物的靶標。相關成果已經發布在《Developmental Cell》的線上版上。
研究概要圖(供圖:京都大學井垣達吏教授和榎本將人助教)
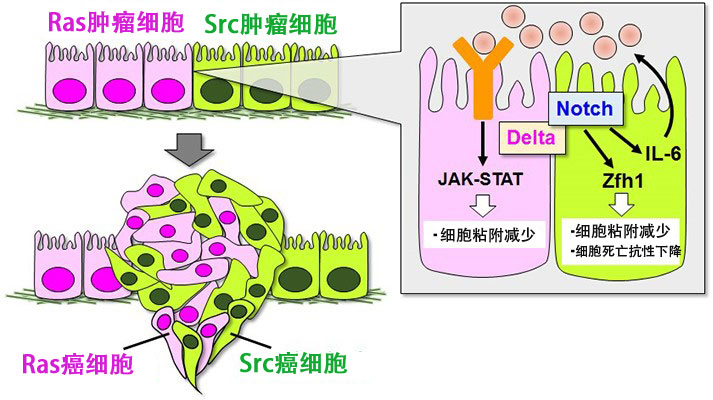
研究團隊在果蠅的複眼組織中導入多種癌基因突變發現,激活的Ras良性腫瘤細胞與激活的Src3良性腫瘤細胞彼此相鄰時,腫瘤細胞獲得了浸潤和轉移能力。
Ras細胞中Delta配體的表達增加,Src3細胞中Notch接受者的表達增加,二者通過在細胞外相輔作用,激活了Src3細胞内的Notch信號。研究發現,Notch信號通過誘導轉錄調節因子Zfh1(在人體中為ZEB1)表達來降低使細胞相互粘附的E鈣粘蛋白和誘導細胞死亡的Hid蛋白的表達量,從而使良性腫瘤具備浸潤和轉移能力。
在Src細胞内激活的Notch信號會誘導IL6表達,被分泌到細胞外的IL6通過相鄰的Ras細胞的細胞表面接受者激活Ras腫瘤細胞内的JAK-STAT信號,Ras腫瘤細胞内的E鈣粘蛋白表達量也下降,從而發生癌變。
井垣教授表示:「該現象還是首次被報告,接下來我們想首先確認小鼠和人體癌細胞中是否也存在同樣的現象。然後打算以Delta和Notch為標靶,研究不同於以往的新的癌症治療法。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













