東京大學研究生院理學系研究科生物科學專業的研究生平井誠也和該校定量生命科學研究所染色質結構功能研究領域的胡桃坂仁志教授等人組成的研究團隊,在與大阪市立大學研究生院工學研究科化學生物系專業的立花太郎教授、九州大學生物防禦醫學研究所的富松航佑助教和大川恭行教授等人開展的聯合研究中,通過小鼠組蛋白H3mm18闡明瞭新型DNA摺疊的基礎結構,並全球首次發現H3mm18控制肌肉分化。
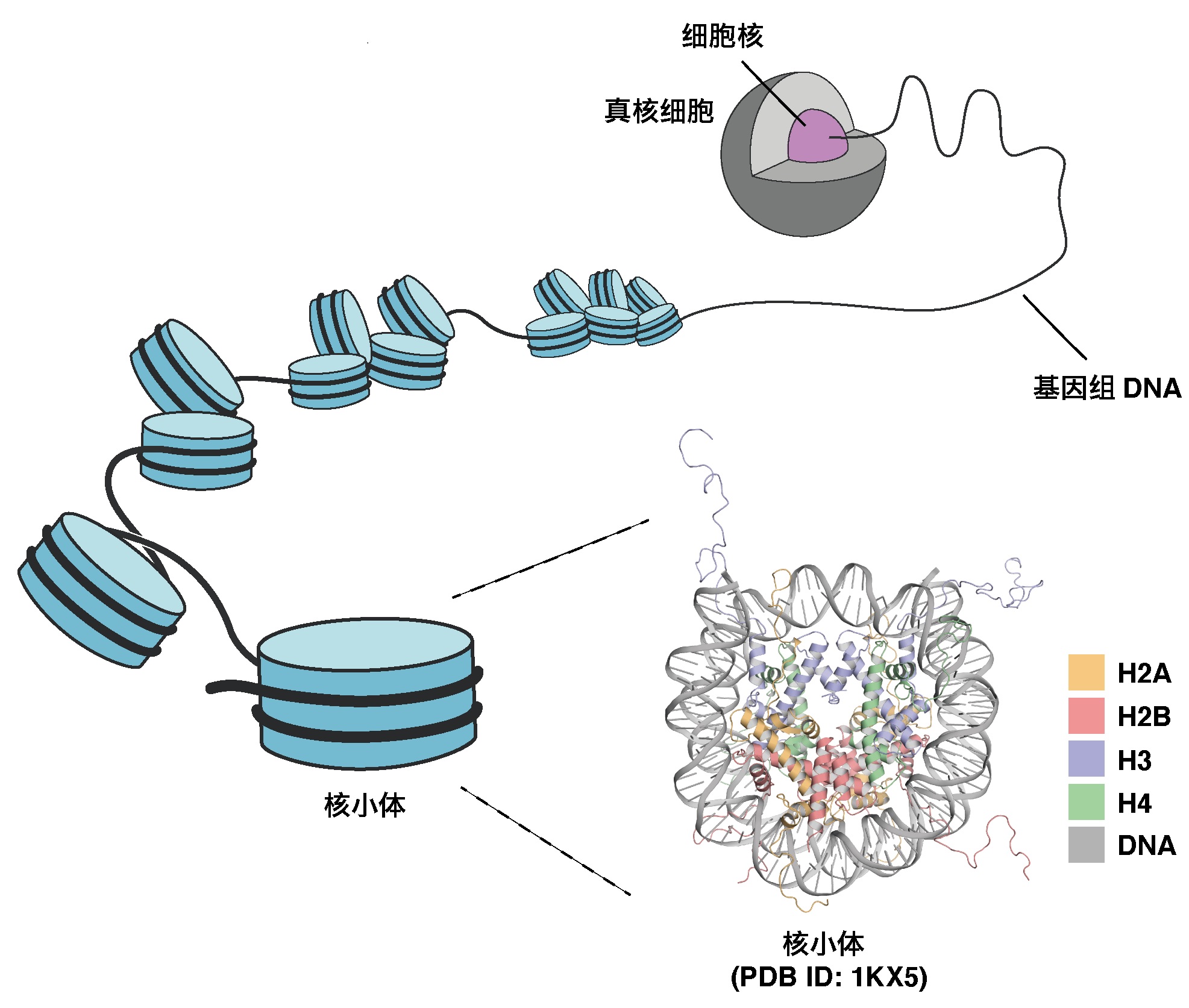
圖1:細胞核内的DNA摺疊和核小體(供圖:東京大學定量生命科學研究所)
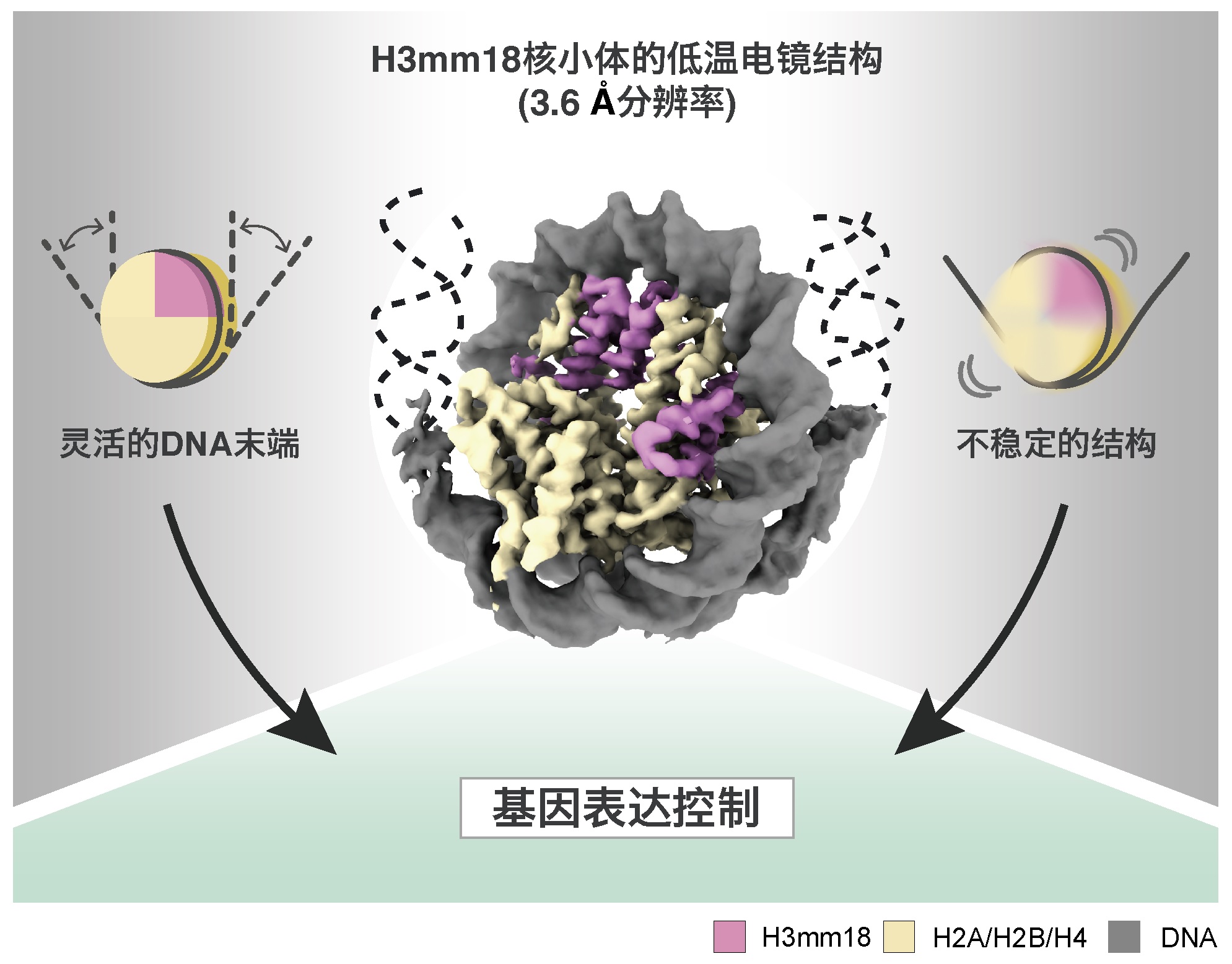
圖2:H3mm18核小體的低溫電鏡結構(供圖:東京大學定量生命科學研究所)
在人類等真核生物中,攜帶遺傳資訊的DNA纏繞在組蛋白上被摺疊。前述研究團隊此前發現了新種組蛋白H3的亞種H3mm18,但並不清楚其功能。
此次,研究團隊通過純化小鼠的4種組蛋白H3mm18、H2A、H2B和H4,並使其在試管中與DNA發生反應,重組了核小體。利用低溫電子顯微鏡觀察重組核小體,確定了H3mm18核小體的詳細空間結構。
通過這種空間結構確認,與正常型核小體相比,H3mm18核小體中的DNA末端區域會靈活移動。另外,為調查核小體的結構穩定性,測試了H3mm18核小體對熱的穩定性。由此發現,H3mm18會形成極不穩定的核小體。
根據以上結果,研究團隊認為H3mm18是通過大幅改變核小體的結構和性質來改變基因體DNA的摺疊結構的。
另外,還通過細胞實驗調查了這種摺疊結構的變化引起的基因表現控制。由於已確認H3mm18在小鼠骨骼肌組織的細胞中獨特性表達,因此認為其參與了骨骼肌分化的基因控制。於是,研究團隊利用表達H3mm18的小鼠成肌細胞進行了骨骼肌分化誘導,發現MyHC和Myog等形成骨骼肌所需的基因表現減少,並且抑制了成肌細胞向骨骼肌分化。
這些結果表明,H3mm18通過改變DNA的摺疊結構來控制肌肉發育中至關重要的基因。此前分析的組蛋白亞種主要是與基因體DNA穩定結合的類型,H3mm18核小體的不穩定性在截至目前的組蛋白H3亞種中尤為突出。
胡桃坂教授表示:「組蛋白亞種和化學修飾在不依賴DNA序列的基因控制的表觀遺傳學中發揮著核心作用。已知表觀遺傳學缺陷會引起癌症、生活方式病和精神病疾患等多種疾病。今後打算了解相關機制,為開發預防和治療這些疾病的方法做貢獻。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













