研究人員發現,被認為會引起阿茲海默症等神經退行性疾病的澱粉樣蛋白聚集體的毒性有強有弱,而這種毒性的大小是由一個氫原子大小的運動幅度的差異引起的。
日本量子科學技術開發機構(QST)量子生命科學研究所的松尾龍人主任研究員、法國勞厄-朗之萬研究所的Alessio De Francesco博士,以及法國格勒諾布爾·阿爾卑斯大學的Judith Peters教授等人組成的聯合研究團隊在針對澱粉樣蛋白聚集體的研究中全球首次發現,對細胞具有不同毒性強度的聚集體之間,原子運動的幅度和速度存在差異。松尾主任研究員介紹說:「目前,阿茲海默症的治療藥物中有靶向神經遞質的藥物,而抑制聚集體形成的藥物還在開發之中。此次發現了控制毒性強度的原子運動。通過研究聚集體本身,今後也許能開發出延緩或阻止病情進展的藥物。」相關研究成果已經發布在Frontiers in Molecular Biosciences上。
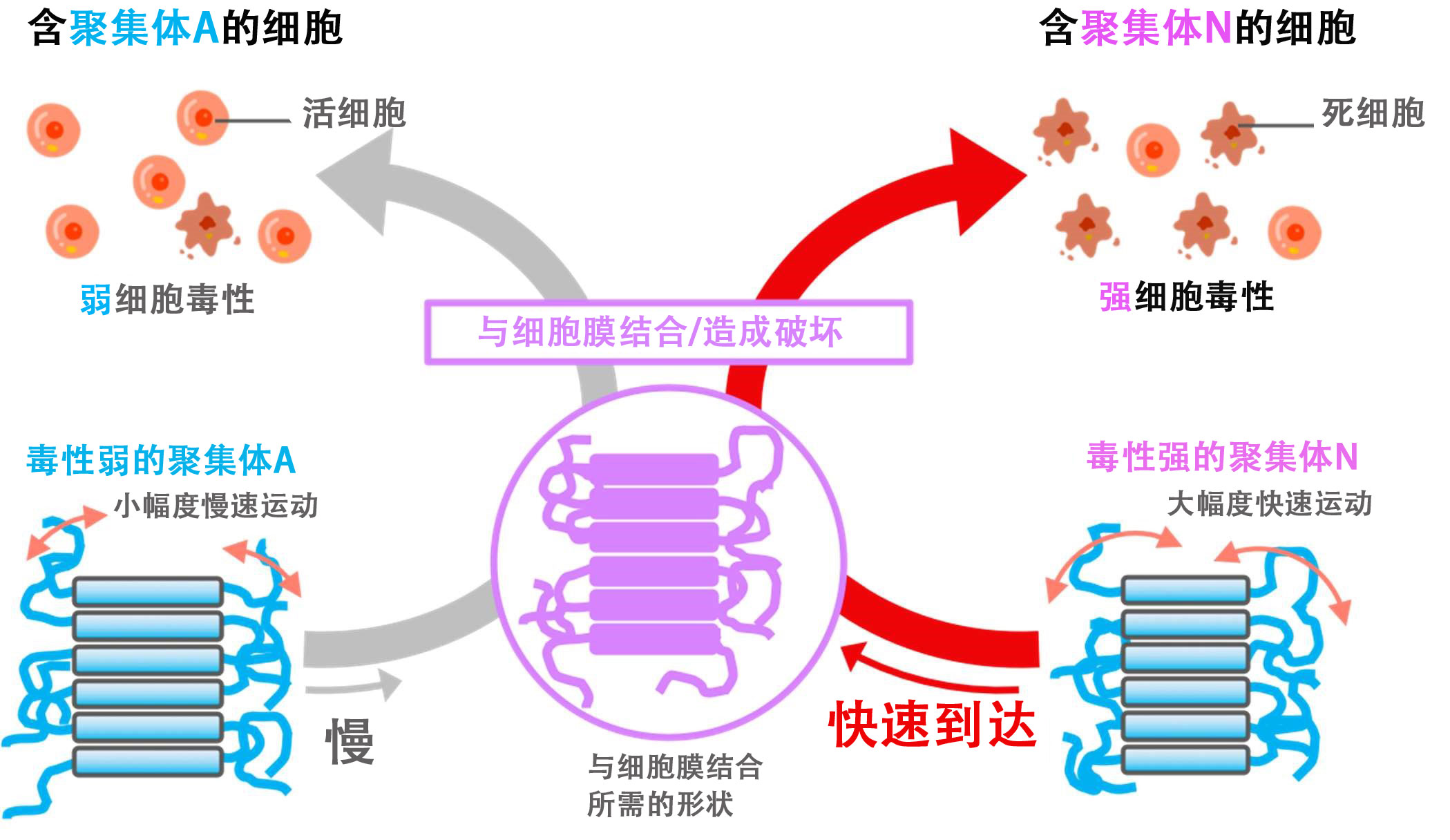
根據此次的研究成果推測的原子運動不同導致澱粉樣蛋白聚集體細胞毒性差異的機制(供圖:日本量子科學技術開發機構量子生命科學研究所)
阿茲海默症(AD)是一種常見神經退行性疾病,每200人中就有1人受到影響,全球每7秒就有1人發病,已成為嚴重的社會問題。它被認為是澱粉樣蛋白聚集體破壞周圍的細胞而引起的。作為澱粉樣蛋白的模型,據報告,由在酸性條件下聚集和分散溶菌酶的纖維組成的聚集體A細胞毒性較弱,而在中性條件下聚集溶菌酶,由短纖維集結形成的聚集體N細胞毒性較強。然而,關於細胞毒性為何存在差異,儘管有人提出了「強毒性聚集體的運動比弱毒性聚集體更激烈」的假說,但此前並沒有實際驗證過。
為了確認這個假說,研究團隊利用勞厄-朗之萬研究所世界最大規模研究用反應堆中設置的中介子非彈性散射裝置,在原子層面分析了聚集體的運動。分析發現,毒性強的聚集體,原子的運動幅度更大,速度更快。運動速度相差1.5倍左右,運動幅度相差約1埃。也就是說,約1個氫原子大小的微小差異決定了聚集體的性質。
聚集體會與細胞膜結合引起毒性,但這種結合需要構成聚集體的蛋白質運動,變成容易與細胞結合的形狀。毒性強的聚集體會快速到達細胞膜,通過大幅度運動(變化)變成容易與細胞結合的形狀,發揮細胞毒性。數百皮秒時間尺度的運動差異會造成3倍的毒性差異。
松尾主任研究員表示:「我們今後打算在計算機上進行模擬等,並與可以做動物實驗的研究室推進聯合研究,以開發新的治療藥物和治療方法。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













