東京醫科齒科大學研究生院醫齒學綜合研究科的橫田隆德教授、永田哲也項目副教授和大谷木正貴(研究生)的研究團隊宣佈,利用獨自開發的異源核酸成功實現了以往難以實現的淋巴細胞内源基因的高效控制。通過使用結合維生素E的異源核酸作為配體,可以高效控制靶淋巴細胞的α4β1整合素基因。經確認,給藥後多發性硬化症小鼠等多種模型小鼠的病情均得到了改善。這一結果有望用來開發以前難以實現的與淋巴細胞相關的自體免疫性疾病等多種疾病的治療藥物。相關成果已經發布在國際科學期刊《Nature Communications》12月22日號上。
(供圖:東京醫科齒科大學)
核酸藥物能都可對靶RNA進行選擇性控制,目前全球已經批准15種核酸藥物。其中就有作為脊髓性肌萎縮症等以往難以治療疾病的治療藥物。另一方面,對於靶向淋巴細胞(B細胞、T細胞)進行治療的自體免疫性疾病,由於淋巴細胞的藥物吸收效率比較低,一直未能實用化。
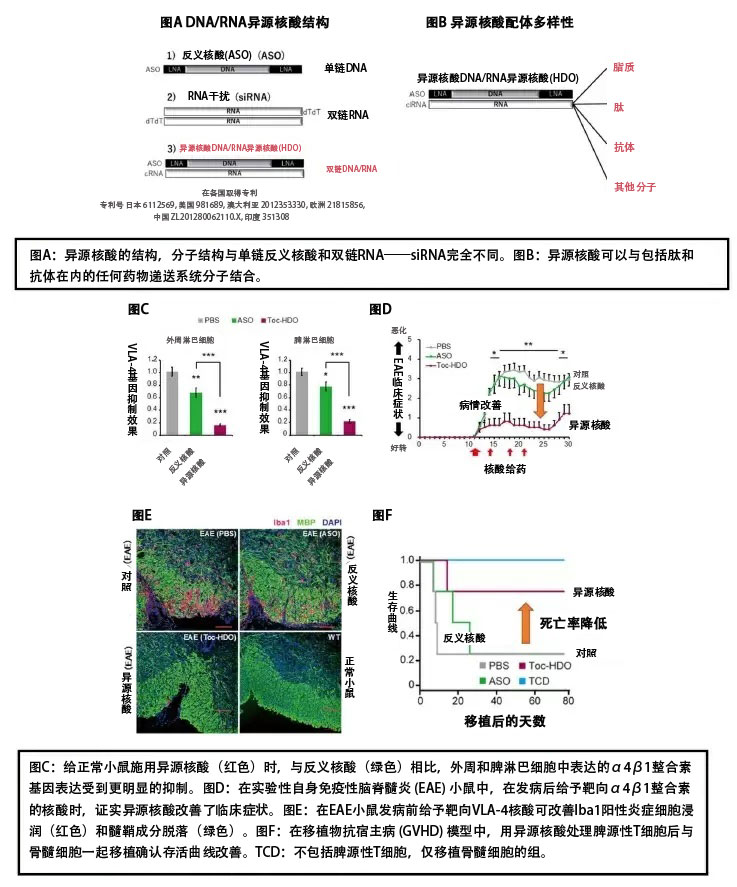
研究團隊此前開發出了分子結構和細胞内作用機制與反義核酸(ASO)和RNA干擾不同的DNA/RNA異源雙鏈核酸(異源核酸),並確認高度有效。
此次進一步驗證了異源核酸對淋巴細胞的有效性。首先以T細胞穿過血腦障壁時利用的粘附分子配體α4β1整合素(VLA-4)為靶標,設計了結合維生素E的異源核酸。對正常小鼠給藥後確認,能以低於ASO的劑量持續且顯著地抑制靶RNA。
對多發性硬化症模型小鼠(EAE:實驗性自體免疫性腦脊髓炎)給藥後確認,在T細胞和B細胞中均對RNA表達和蛋白質表達有高度抑制效果。發病前給藥將發病時間延遲了10-15天,還能抑制T細胞的浸潤和發炎,並確認到症狀得到了改善。在被認為VLA-4與發病有關的移植物抗寄主病(GVHD)模型小鼠中也確認比ASO大幅降低了死亡率。
研究團隊認為,與此前報告的ASO和異源核酸的吸收途徑不同,可能存在異源核酸特有的吸收途徑。
目前為進一步提高吸收效率,研究團隊正與製藥公司就異源核酸的結構進行聯合研究。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













