在腎臟中,大量腎單位分別排列在分出大量分支的集合管末端,形成像西藍花一樣的高階結構。此前很難僅利用ES細胞或iPS細胞形成這種高階結構。熊本大學發生醫學研究所的西中村隆一教授和谷川俊祐講師與研究生田中悅子等人組成的研究團隊,成功地僅利用ES細胞培養出了擁有高階構造的腎臟。另外還將培養的腎組織移植到小鼠體內,確認血管能進入組織並成熟。該成果朝著培養移植用腎臟的新一代再生醫療邁出了一大步。相關内容已發布在Nature Communications的網路版上。
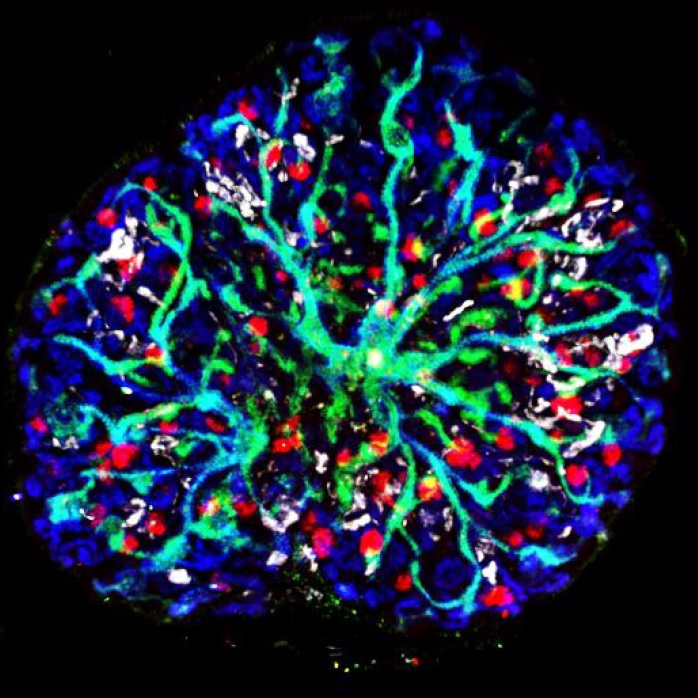
僅利用ES細胞培養的腎臟(圖片由熊本大學的西中村隆一教授提供,未經許可,嚴禁轉載)
腎臟通過產生尿液在維持生命方面發揮著重要作用,但是無法再生。日本有1300多萬慢性腎耗竭患者,其中34萬人在接受人工透析,但由於缺少供體,能進行腎移植的人非常有限。
成年人的腎臟有100萬個腎單位(腎小球和腎小管),小鼠也有1萬個,這些腎單位通過集合管末端相連。腎單位與集合管之間的縫隙由間質填充,間質來自間質祖細胞。間質祖細胞還負責控制腎單位的分化和輸尿管芽的分支,因此沒有間質祖細胞就無法形成腎臟的高階結構。
研究團隊2014年確立了利用小鼠ES細胞或人iPS細胞培養腎單位祖細胞的誘導法,2017年發布了誘導輸尿管芽的方法。
此次又開發出了間質祖細胞的誘導法。
首先利用11.5天的胎鼠腎臟,確定了間質祖細胞的特徵性基因簇及其發育機制。然後,確立了利用抗體分離作為間質祖細胞起源的後中間中胚層的方法,以及將其誘導為間質祖細胞的培養條件。以此為基礎,開發了利用小鼠ES細胞,通過後中間中胚層誘導間質祖細胞的方法。通過將誘導的間質祖細胞與同樣利用ES細胞誘導的腎單位祖細胞和輸尿管芽相結合併在試管内進行培養,成功形成了腎單位排列在分出大量分支的集合管周圍的腎臟固有高階結構。
將培養的腎組織移植到免疫缺陷小鼠體內後,血管進入組織並進一步成熟,對過濾功能至關重要的系膜細胞和調節血壓的腎素生成細胞等特殊間質細胞也從ES細胞中分化出來。也就是說,通過確立形成腎臟所需的三個必須部分中此前缺少的第三部分(間質祖細胞)的誘導法,成功構建了完全來自富潛能幹細胞的高階結構腎臟。
谷川講師表示:「移植的類器官的腎單位數量約為50~100個,增加腎單位數量並使其成熟可能還需要其他因素。另外,由於還沒有形成連接尿道的輸尿管,因此尿液等收歛積在集合管中。今後打算形成延伸到腎臟外的輸尿管,同時確定使其進一步成熟的因子。」
西中村教授表示:「人類胎兒的腎臟無法像小鼠那樣輕易用於實驗,因此要使用數據庫中公開的基因表現資訊,希望今後1~2年能培養出來自人iPS細胞的腎臟高階結構。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













