北海道大學研究生院醫學研究院腫瘤病理學教室及該校創成研究機構化學反應創成研究基地(WPI-ICReDD)的田中伸哉教授和津田真壽美副教授等人組成的研究團隊,全球首次成功地利用從大腸癌患者體內切除的癌組織剖切上評估了每位患者的癌細胞有多大的移動能力。
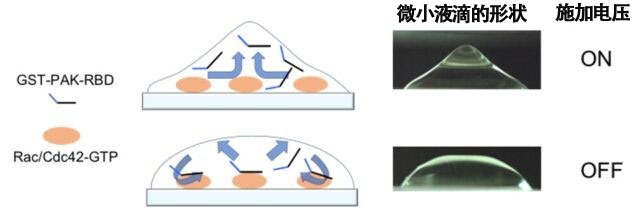
利用電場非接觸攪拌技術改變微小液滴的形狀。通過反復施加低頻電壓並高速攪拌含GST-PAK-RBD探針的液體,成功地使GST-PAK-RBD探針快速與癌細胞内被激活的Rac/Cdc42(Rac/Cdc42-GTP)獨特性結合。(提供:北海道大學)
癌細胞的移動能力(運動和浸潤能力)由低分子量G蛋白Rac和Cdc42控制,這些分子越活躍,癌細胞的移動能力越強,越容易向血管和淋巴管中侵襲和轉移。此前一直通過Rac/Cdc42拉下實驗對癌細胞的運動和浸潤能力進行生化評估。但這樣會完全失去在癌組織内的位置資訊,也無法評估細胞的異質性。
為此,研究團隊利用近年來開發的電場非接觸攪拌技術,在用於病理診斷的癌組織剖切上(FFPE樣本)以極高的速度攪拌與被激活的Rac/Cdc42相結合的探針溶液,能夠快速並特定性評估大腸癌細胞的運動和浸潤能力。
評估結果顯示,細胞的Rac/Cdc42活性①與大腸的正常粘膜相比在腫瘤區域顯著升高;②癌細胞的惡化階段越高,Rac/Cdc42的活性越高;③在癌細胞浸潤周圍正常組織的尖端尤其高。另外還發現,④Rac1/Cdc42活性較高的病例容易發生淋巴管浸潤。
津田副教授表示:「在該技術開發過程中,我們為如何抑制染色背景和檢測獨特性信號而苦惱。這項技術不僅適用於大腸癌,還適用於乳房癌和腦腫瘤,並有望在預測癌細胞的淋巴結轉移,以及未來將Rac抑制劑用於伴隨診斷時提供重要資訊。」
【詞注】
Rac/Cdc42:低分子量G蛋白Rho家族的主要成員。在GTP(鳥苷三磷酸)與Rac和Cdc42結合時激活,GDP(鳥苷二磷酸)與Rac和Cdc42結合時失活。被激活的Rac/Cdc42會促進癌細胞的運動和浸潤能力。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













