【導讀】以光合作用為首,植物具備有效生成有用物質的機制。近年來,嘗試將植物的這種特性應用於產業領域的研究非常活躍。其中,著眼於細胞内小器官「胞器」研究的是領導ERATO「沼田胞器反應簇項目」的京都大學研究生院工學研究科教授沼田圭司。其研究目標是通過確立能自由控制胞器的技術,培育出具有最適合物質生產機能的植物,從而在以植物為起點的各行各業實現創新。

沼田圭司
京都大學研究生院工學研究科教授
理化學研究所生物巨分子研究團隊組長
2016年起擔任ERATO研究總負責人
比編輯基因體更容易
目標是高功能新物質的生產
為削減二氧化碳和解決能源問題,近年來,利用生物的物質生產受到了廣泛關注。以光合作用為代表,植物可以有效生成有用的物質,這種機制不僅限於食物和能源,如果還能將其應用於材料和藥品等的生產,就有望解決各種社會課題。然而,生物的物質生產機制非常複雜,人類尚未從根本上解明這些機制。因此,現階段還無法自由設計適合生產所需物質的最佳生物。
領導ERATO「沼田胞器反應簇項目」的京都大學研究生院工學研究科教授、理化學研究所環境資源科學研究中心生物巨分子研究團隊的沼田圭司組長還是研究利用生物生產物質的科研人員之一。沼田在博士課程期間學習了高分子晶體結構分析後赴美留學,留學期間研究了作為再生醫療和生物材料使用的絲蛋白中所含的β摺疊結構的毒性評估,以及向細胞内輸送目標分子的方法等課題。他回憶當時的情況說:「研究的重點放在了聚合物科學上,同時學習瞭如何操作細胞和導入各種物質。」
回國後,沼田開始在理化學研究所從事研究如何使植物細胞產生生物塑料的一種——聚羥基鏈烷酸。然而,即使修飾核DNA,也無法獲得所期待的產量。調查原因後發現,是因為來自胞器之一的粒線體的物質不足。沼田說:「無論對核DNA進行多少操作,如果不增強胞器的功能,就很難真正大量生成生物所需的物質,所以我們認為,需要在輸送基因修飾分子的對象中增加胞器。」
在此之前,胞器的修飾尚無方便易用的方法,研究也不夠充分,所以必須開發,胞器的修飾方法。另一方面,沼田表示DNA修飾也需要新的方法:「核DNA的修飾開始廣泛使用CRISPR-Cas9等基因體編輯技術。但植物細胞利用CRISPR-Cas9編輯核DNA之後,還需要從核DNA中清除Cas9基因。所以我認為還需要開發一種更簡便的方法。」
沼田表示研究的最終目標是利用植物生產高功能的新物質,由此創造出新材料。他認為僅單獨確立核DNA和胞器的修飾技術很難達成目標,於是新設定了一個更大的目標(圖1)——通過胞器的功能和相輔作用明確與植物的物質生產所有相關的機制,並確立改良植物表徵的基本技術,為此沼田成立了ERATO項目。
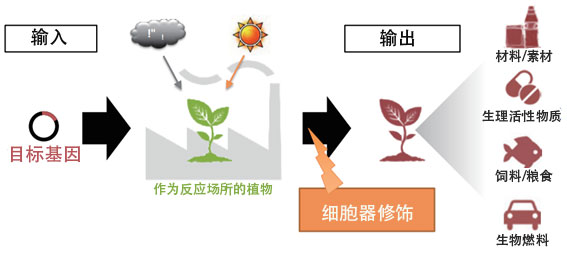
圖1:利用植物胞器的物質生產
人工創造細胞穿膜肽
在葉綠體和粒線體中導入DNA
ERATO最初組建了「融合肽設計組」、「胞器修飾組」和「胞器相輔作用組」三個研究小組來推進研究。融合肽設計組負責利用巨分子化學知識設計向細胞内運送分子的肽;胞器修飾組利用獲得的肽修飾核DNA和胞器DNA;胞器相輔作用組利用各種裝置確認基因的表達。目前,為與其他研究機構開展聯合研究,又增加了由研究藻類和人體細胞的研究人員參加的「融合肽利用組」,目前共有四個小組在推進研究。
目前,沼田向植物粒線體中選擇性導入DNA的研究已經獲得成功,正在通過各種植物細胞探索能有效進入細胞的細胞穿膜肽(CPP,圖2)。研究人員以動物細胞常用的肽為中心建立了由55種CPP構成的資源庫,並利用菸草、擬南芥、番茄、白楊和水稻等植物,評估了導入效率和導入方式。研究結果表明,CPP的導入效率和定位因植物種和組織而異,另外還確定了多種對所有植物種都有效的CPP。
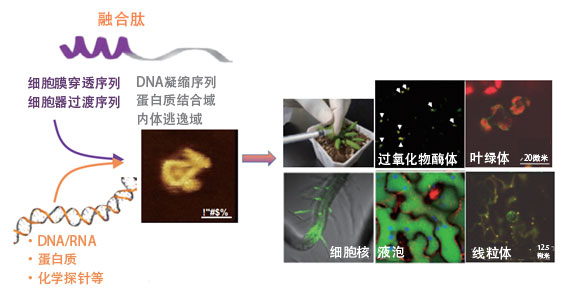
圖2:利用肽的各種功能,將目標物質輸送到植物中的特定位置。
接下來,沼田根據取得的研究結果嘗試向植物和藻類的色料體中導入了DNA。製作了想輸送至色料體中的環狀質體DNA、含有促進葉綠體吸收的葉綠體過渡序列肽、以及在帶正電的肽復合體中添加CPP的團簇,然後注入模型植物擬南芥的葉子中。由此DNA按預期被成功地導入了葉綠體中(圖3)。
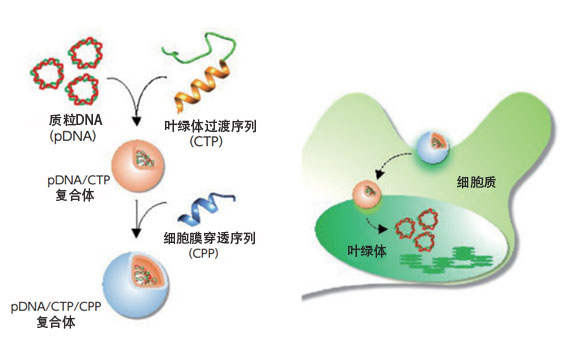
圖3:通過將質體DNA與含葉綠體過渡序列的肽復合化,並添加含CPP的肽,形成了包含兩種功能肽的團簇,然後成功地將其導入了植物内部的色料體中。
上述實驗取得成功後,沼田又嘗試利用同樣的方法分別向存在於菸葉葉綠體、番茄果實和馬鈴薯根莖中的色料體有色體及澱粉體中導入DNA,雖然效率和導入時間上存在差異,但所有實驗均取得了成功,並確認導入的DNA獲得了正常表達(圖4)。沼田說,雖然如願實現了目標技術之一,但還存在有待解決課題。他介紹說:「這項實驗使用的CPP和復合體的導入效率較低。如果我們想利用植物細胞來生產物質,則需要大幅提高導入效率」。為此,沼田開始致力於改良CPP。
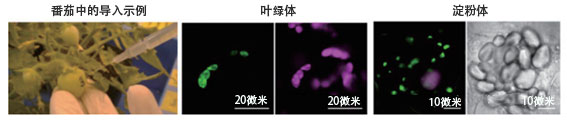
圖4:左圖是向番茄果實中導入肽和DNA簇的情景。中間兩圖為菸葉葉綠體的共聚焦雷射顯微鏡圖像,其中左側綠色表示報告基因的表達,粉色為葉綠體。右側兩圖為馬鈴薯根莖的澱粉體圖像,其中左側共聚焦雷射顯微鏡圖像中的粉色為報告基因的表達,綠色為葉綠素,右側的明場圖像顯示的是無色澱粉體的聚集。
為探索效率更高的CPP,沼田嘗試了以前報告的所有具備相似功能的肽,發現滲透性因對象細胞而異。因此,沼田通過添加天然不存在的人工氨基酸,成功提高了對肽分解酶更具穩定性的肽。
另外,導入細胞的方法決定著肽能否被運送至目標胞器中。例如,細胞膜上形成凹陷,目標物質像被凹陷包圍起來一樣進入細胞内的胞吞作用,如果是植物細胞,則肽被運送至液胞時,如果是動物細胞,則肽在被運送至溶體時,大部分的肽就都分解了。這種狀態下,即使提高向細胞内運送分子的效率,肽也很難到達目標胞器,並在那裏發揮操作DNA的功能。
成功地直接導入蛋白質
利用人工肽效率提高20倍
沼田指出,這些課題並不隻侷限於植物。在開發向目標器官的細胞遞送藥物的奈米載體時,確立避免胞吞作用的方法同樣也是一個課題。「為實現有效的細胞膜穿透序列而合成各種人工功能肽時,發現了一種肽恰好能利用胞吞作用以外的途徑進入」,沼田滿面笑容地說到。分析發現,這是一種通過誘導此前植物細胞未曾報告過的與巨胞飲作用的入胞機制相似的現象,而使得肽進入細胞的(圖5)。

圖5:巨胞飲作用是將細胞外的物質吸收到細胞内的一種機制,吸收過程會形成特徵性的細胞膜突起結構和直徑為200奈米(10億分之1 米)以上的細胞內囊泡。
沼田還利用這樣獲得的功能肽(dTat-Sar-EED4),嘗試向植物中直接導入了功能蛋白質——首先製備dTat-Sar-EED4與水解酶的復合體,確認能否導入菸草培養細胞和擬南白芥子葉等模型植物中,最終利用螢光顯微鏡確認到了酶在細胞内的表達(圖6)。沼田感覺良好地說:「經確認,與之前用於植物細胞的CPP相比,導入效率最大提高20倍。今後有望成為修飾胞器的有力武器。」
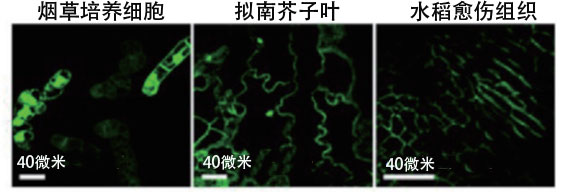
圖6:在人工細胞穿膜肽(dTat-Sar-EED4)的作用下,水解酶β-葡萄醣醛酸苷酶(GUS)以活性狀態分別被導入三種模型植物的螢光顯微鏡圖像。
另一方面,簡便修飾植物細胞核DNA的技術研究也取得了成果。沼田等人研究了將CRISPRCas9中可直接切斷基因體的蛋白質Cas9直接導入細胞的技術。具體來說,利用可以封入蛋白質的奈米級膠囊,在其表面附著CPP後,導入了用擬南芥組織製備的未分化細胞塊——癒傷組織中,確認可以有效進入細胞内,並成功地使目標基因發生了典同質多相變體異(圖7)。

圖7:將封在奈米膠囊中的Cas9 RNP遞送至植物的癒傷組織細胞中,進行基因體編輯。
與嵌入CRISPR-Cas9所需的基因,並使其在細胞内部表達以修飾DNA的常規方法相比,上述方法不僅操作簡單,還減少了破壞目標基因以外基因的脫靶現象。作為更安全的植物基因體編輯技術備受期待。另外,最新的研究還成功開發了通過噴霧將核酸導入植物中來修飾植物的更簡單的方法(圖8)。沼田說:「這些方法作為高度通用的安全基因體編輯技術,還能用於各種實用植物的品種改良。」
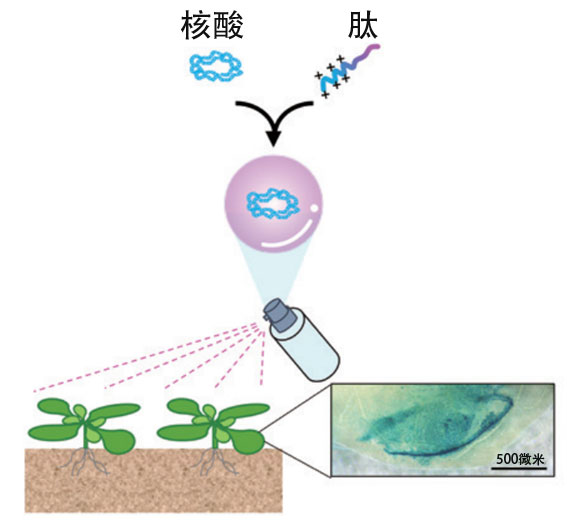
圖8:向植物體噴灑核酸-肽復合體
著眼於產業應用的合成蛛絲
下一個課題將是解析相輔作用
使用這些基礎技術的應用研究也已開始。例如,利用光合細菌製造蛛絲的研究。蛛絲雖然非常輕,但其韌性可以與鋼鐵媲美,在需要耐強烈衝擊的建築結構材料方面的應用備受期待。然而,用於建築結構材料的大量蛛絲很難僅通過飼養蜘蛛獲得,目前正在開發向各種生物細胞導入基因進行量產的技術。
沼田等人還把棒絡新婦蜘蛛蛛絲的主要成分MaSp1蛋白的基因導入到紅色光合細菌中並成功進行了生產。將所獲得的MaSp1在有機溶劑中延伸後,會形成與蛛絲非常相似的纖維,利用電子顯微鏡觀察確認,從斷裂面開始,内部形成了纖維結構(圖9)。研究人員目前還在用9升的大型培養槽進行試驗,如果能實現實用化,就有望在削減溫室氣體的同時合成有用的物質。
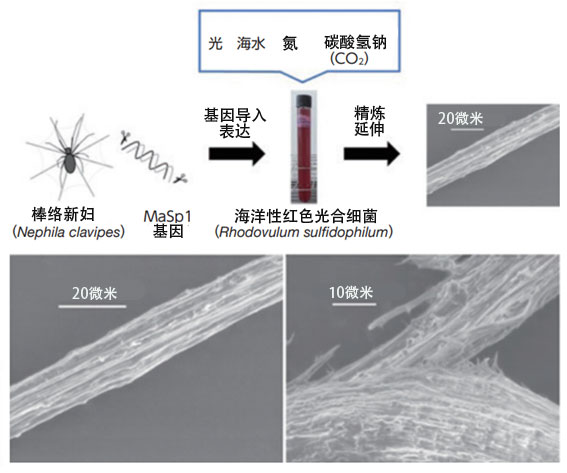
圖9:在730奈米紅外LED照射下,邊向人造海水中添加作為碳源的焙鹼和作為氮源的氮氣,邊培養海洋性紅色光合細菌,獲得了蛛絲。左下圖是通過MaSp1蛋白獲得的纖維掃描電子顯微鏡圖像。右下圖是纖維斷裂面的掃描電子顯微鏡圖像。
除此之外,利用培養細胞合成天然橡膠以及生產均質人工木材的研究也已開始。然而,進一步提高生產效率對於實際的工業應用至關重要。沼田就接下來的課題表示:「為此還需要明確胞器之間的複雜相輔作用。」
作為這方面的一個線索,沼田報告了粒線體隨著與葉綠體的相輔作用輕微鏈段運動的現象(圖10)。研究發現,在細胞内,不同性質的胞器會相輔作用,參與物質的代謝。如果能積累這些知識,提高各個胞器的功能,並控制其相輔作用,從而提高細胞的代謝能力,就一定可以向沼田描繪的未來邁出堅實的一步。
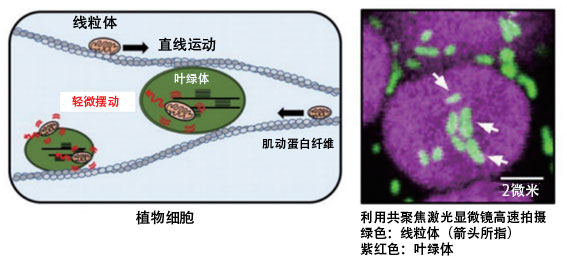
圖10:擬南芥葉肉細胞中的粒線體運動示意圖(左)及利用共聚焦雷射顯微鏡高速拍攝的圖像(右)。研究發現,不同於直線運動的輕微鏈段運動與葉綠體的相輔作用有關。
原文:JSTnews 3月號
翻譯編輯:JST客觀日本編輯部














