由理化學研究所(簡稱「理研」)生命功能科學研究中心蛋白質功能結構研究團隊的組長白水美香子和技術官保坂俊彰、理研放射光科學研究中心分子動畫研究團隊的組長南後惠理子、理研SACLA利用技術開拓團隊的岩田想主任、兵庫縣立大學研究生院理學研究科的久保稔教授、高輝度光科學研究中心XFEL利用研究推進室的首席研究員登野健介、東京大學研究生院理學系研究科的濡木理教授,以及東京大學大氣海洋研究所附屬地球表層圈變動研究中心的吉澤晉副教授等人組成的聯合研究團隊,利用X射線自由電子雷射(XFEL)設施SACLA進行高解析度結構分析,成功闡明瞭可在太陽光等光的作用下將氯離子輸送到細胞内的海洋細菌源光碟機動型離子泵視紫質的結構變化。
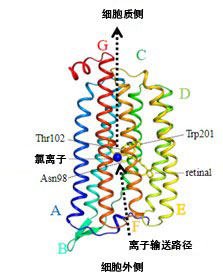
光碟機動型離子泵視紫質NM-R3的空間結構(藍色圓為正在輸送的氯離子,供圖:理研)
研究團隊通過大腸桿菌無細胞合成系統合成了NM-R3(將氯離子輸送到細胞内的蛋白質),並使用含溴離子和碘離子的溶液取代氯離子進行純化,通過LCP法制備了大量微晶體。當這些微晶體被光照射後,觀察到光吸收率在微秒至毫秒的時間單位變化的現象,這表明,即使在晶體中,隨著NM-R3的結構發生變化,離子輸送機制也會發揮作用。
另外,研究團隊為利用XFEL設施SACLA進行時分晶體結構分析,向加入溴離子純化的NM-R3微晶照射波長為540奈米的綠色雷射,收集了1毫秒後的數據。結構分析結果顯示,視黃醛的結構變化會引起多個α-螺旋統合運動,由此在細胞質側形成了離子通過的空間,細胞外側則觀測到了防止離子回流和過度流入的結構變化。
此外,研究團隊還利用通過碘離子純化的NM-R3微晶進行了同樣的時分晶體結構分析。由於異常色散效應,碘離子具有比溴離子更容易確定位置的特性。研究團隊利用這種特性,嘗試確定了照射光後10微秒和1毫秒時輸送的碘離子的位置。分析結果顯示,10微秒後碘離子移動至存在於helixC中的細胞質側第102位必須氨基酸蘇胺酸(Thr102)附近。
另一方面,1毫秒後碘離子的結合位置消失,這表明已經被排出,並且碘離子排出口附近的細胞質側的helixC、helixF和helixG周邊存在輸送碘離子的路徑。
白水組長表示:「NM-R3是一種光反應蛋白,能輕鬆控制其結構變化的起始。然而,大部分蛋白質對光沒有反應,因此很難控制酶反應。今後我們將進一步修飾普通蛋白質,使其對光發生反應,並推進旨在觀察更廣泛的蛋白質結構變化的研究。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部













