日本理化學研究所環境資源科學研究中心天然物生物合成研究組的組長高橋俊二和特別研究員Nhu Ngoc Quynh Vo,與技術基礎部門生命分子解析組的特別研究員野村勇太(當時,現為埼玉大學助教)等人組成的研究團隊,利用細菌的蛋白質數據庫探索了生成萜類的酶基因,發現了可以從法尼基焦磷酸(FPP)中有效生成Drimenol(雙環倍半萜)的海洋細菌源新倍半萜合酶。
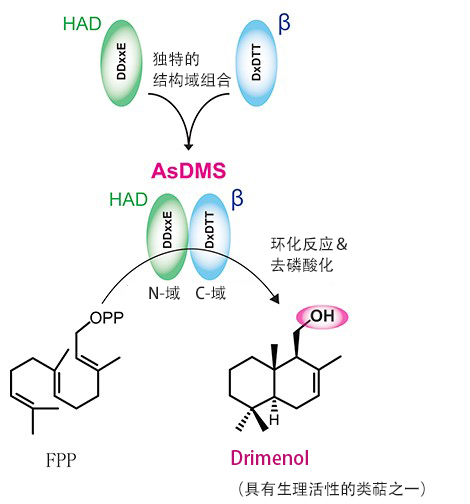
圖:源自海洋細菌的新Drimenol合酶的結構域
源自Aquimarina spongiae的DMS(AsDMS)具有利用N-域的DDxxE模體和C-域的DxDTT模體催化法尼基焦磷酸(FPP)生成Drimenol的環化反應和脫磷酸作用反應的活性。AsDMS是在演化過程中鹵酸脫滷酶(HAD)樣水解酶結構域與萜烯類合酶的β結構域融合形成的新型酶。(供圖:理化學研究所)
研究團隊以從絲狀真菌米麴黴(Aspergillus oryzae)中獲得的倍半萜合酶(AstC)的胺基酸序列為基礎,從細菌的蛋白質數據庫中探索了類似的酶基因。另外,還通過胺基酸序列分析,選出了六個保留萜烯類合酶共有的重要模體DDxxE和DxDTT的候選酶基因。
為分析這些酶基因的功能,研究團隊利用人工合成DNA製備了表達載體,在大腸桿菌中表達了酶。利用純化酶和多種基質分析反應發現,有五種酶是能從法尼基焦磷酸(FPP)中生成Drimenol的Drimenol合酶(DMS)。其中,源自海洋細菌Aquimarina spongiae的DMS(AsDMS)與源自植物的DMS相比表現出更高的催化活性。這個結果表明,此次發現的酶中,AsDMS是最適合以低成本快速生產Drimenol的酶。
此外,研究團隊搭建AsDMS的結構模型發現,基質(FPP)與酶的N端和C端的蛋白質結構空間結合。為驗證負責催化活性的必備區域,製備了在推測存在於活性中心的氨基酸中導入位點特異突變的酶,分析了反應。分解結果表明,這種酶由DDxxE和DxDTT兩個模體構成活性中心,參與通過從FPP環化為Drimenyl Pyrophosphate(中間體)和從Drimenyl Pyrophosphate中去磷酸來生成Drimenol的連續反應。
另外,為調查AsDMS各個結構域的演化起源,還分析了系統發生樹。根據結果預測,AsDMS由鹵酸脫滷酶(HAD)樣水解酶和萜烯類合酶β演化而來,是這兩個功能域融合形成的新萜烯類合酶。
高橋組長表示:「此次研究中發現的AsDMS是由從不同酶起源演化而來的鹵酸脫滷酶樣水解酶區域和萜烯類合酶β區域構成的新型酶。今後通過進一步進行基因體探索研究,有望發現具有新功能的萜類合酶。」
【詞注】
■萜類、倍半萜:萜類是以5碳異戊二烯為構成單位的天然有機化合物的總稱,也稱為萜烯類。作為藥品、農藥、抗微生物劑、香料和食品添加劑使用。倍半萜是從3個異戊二烯相連形成的15碳法尼基焦磷酸(FPP)衍生而來的化合物,根據環化方式的不同存在多種結構。
■模體:對酶反應非常重要的胺基酸序列,在具有相似功能的酶之間保留的區域。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
期刊:ACS Chemical Biology
論文:Identification and Characterization of Bifunctional Drimenol Synthases of Marine Bacterial Origin
DOI:10.1021/acschembio.2c00163













