東京大學研究生院綜合文化研究科的研究生桑崎勇人(研究時)和佐藤守俊教授通過與山本翔太研究員(當時)、小田部尭廣研究員(當時)、神奈川縣立產業技術綜合研究所的中嶋隆浩研究員、理化學研究所生命機能科學研究中心的清水義宏組長、東京都立大學研究生院理學研究科的成川禮副教授,以及哥倫比亞大學復健再生醫療學科和藥理學科的矢澤真幸助理教授等人開展聯合研究,成功開發出了光開關蛋白「MagRed」,由此可利用生物組織穿透性極強的紅光來操控身體深處的生命現象。該成果有助於明確身體深處的生命現象,有望在包括遺傳疾病和細胞治療等生命科學及醫學領域在内的廣泛研究領域發揮作用。相關内容已經發布在《Nature Biotechnology》上。
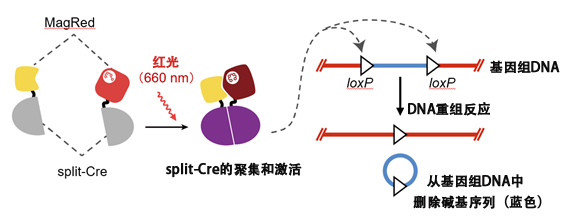
圖1:通過紅光操控DNA重組反應的光操作技術「RedPA-Cre」,其中利用了光開關蛋白MagRed。首先將Cre重組酶一分為二並滅活後製備split-Cre,然後使MagRed與其連接,開發出了遇到紅光後產生DNA重組活性的酶(RedPA-Cre)。由紅光激活的RedPA-Cre可以從基因體中刪除由名為loxP的34個鹼基序列夾在中間的鹼基序列(基因等)。利用這種DNA重組反應,可以用紅光瞄準並敲除基因或者激活基因。(供圖:東京大學研究生院綜合文化研究科廣域科學專業 佐藤守俊教授)
研究團隊著眼於各種細菌的紅色感光蛋白的細菌光敏色料中抗輻射細菌所具有的BphP(DrBphP)。DrBphP作為輔因數與哺乳動物細胞中存在的色料膽綠素(BV)進行結合,其結構會隨著紅光而發生顯著變化。研究團隊認為,通過開發識別DrBphP的結構變化並與其結合的蛋白質(結合劑),可以開發出紅光開關蛋白。
研究團隊製備了抗體樣分子Affibody的突變體Library,利用核糖體展示法,把僅在照射紅光的條件下與DrBphP結合的Affibody作為候選結合劑分離出來。通過對利用這種分子演化工程法獲得的候選結合劑實施氨基酸突變和末端氨基酸刪除等修改,成功開發出了照射紅光時的結合效率得到改善的結合劑。由DrBphP和Affibody(結合劑)構成的光開關蛋白被命名為「MagRed」,意為該研究團隊以前開發的藍色光開關蛋白「Magnet」的紅色版。
當將其他研究團隊報告的兩種紅光開關蛋白應用於基因表現的光操作技術(CPTS)時,儘管在黑暗環境下,但都檢測出了高基因表現活性。而採用MagRed的CPTS(Red-CPTS)在黑暗環境下幾乎檢測不到活性,照射紅光可以有效誘導基因表現,表明MagRed具有非常高的光調控能力。另外,通過照射紅光,基因體中編碼的多個内源基因也成功地被同時激活(最大378倍的激活率)。
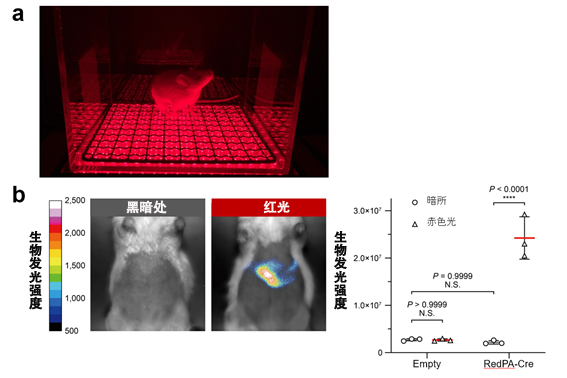
圖2:利用RedPA-Cre,在小鼠身體深處(肝臟)對DNA重組反應進行光操控。
(a)利用LED從小鼠體外非侵襲照射紅光時。
(b)在肝臟中導入RedPA-Cre和生物發光報告(與激活的RedPA-Cre反應並進行生物發光的報告)的小鼠通過從體體外曝露紅光,觀察到了肝臟的生物發光信號。這個結果表明,即使從體體外曝露光,在小鼠身體深處,RedPA-Cre也能高效誘導DNA重組反應。圖中的「P」表示P值。「N.S.」表示無顯著差異。(供圖:東京大學研究生院綜合文化研究科廣域科學專業 佐藤守俊教授)
研究團隊通過將催化DNA重組反應的Cre重組酶一分為二並滅活,使MagRed與分割體連接,開發出了在黑暗環境下不具備DNA重組活性,而照射紅光後會出現高活性的DNA重組酶(RedPA-Cre)。與通過紅光控制的4種常規技術比較發現,能以27~46倍的效率對DNA重組反應進行光操控。另外,通過將RedPA-Cre和Red-CPTS分別引入小鼠肝臟中,並從體外非侵襲照射紅光發現,二者都能在肝臟中有效操控基因功能。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
期刊:Nature Biotechnology
論文:A red light–responsive photoswitch for deep tissue optogenetics
DOI:10.1038/s41587-022-01351-w













