新冠病毒通過使病毒外膜與細胞膜以及内體膜的融合來感染寄主。細胞膜上的接受者和蛋白質水解酶(蛋白酶)在這種膜融合中起著重要作用。東京大學醫科學研究所附屬亞洲傳染病研究基地的特任講師山本瑞生和特任副教授合田仁與東京大學的名譽教授兼特命教授井上純一郎等人組成的研究團隊,發現了不依賴於已知參與膜融合的絲胺酸/半胱胺酸蛋白酶的新的感染途徑。新感染途徑依賴於金屬蛋白酶,這種現象在SARS和MERS等冠狀病毒的感染過程中均沒有發現過,是新冠病毒特有的感染途徑。另外,研究團隊還發現,作為癌症轉移抑制劑開發的多種金屬蛋白酶抑制劑可以有效抑制這種感染途徑,以及抑制與COVID-19的病症有關的病毒感染依賴性細胞融合和細胞的死亡。這些成果不僅有助於明確新冠病毒感染快速傳播的機制以及COVID-19的複雜病症,還有助於開發出針對重症化和後遺症等的治療方法以及預測新突變株的病原性。相關内容已經在mBio網路版上公開。
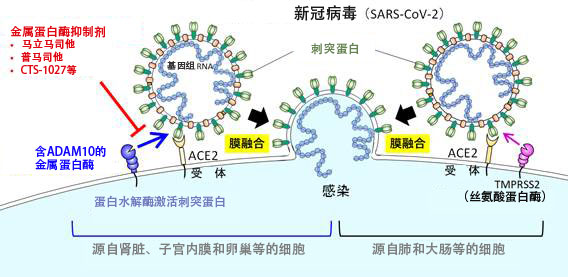
圖1:通過金屬蛋白酶進行的新冠病毒感染示意圖
在源自腎臟、子宮內膜和卵巢等的細胞中,含有ADAM10的金屬蛋白酶參與新冠病毒的膜融合,現有的金屬蛋白酶抑制劑可有效地抑制這種感染途徑。這種依賴金屬蛋白酶的感染是一種獨立的感染途徑,不依賴對肺部和大腸等部位的細胞感染非常重要的絲胺酸蛋白酶TMPRSS2。(圖像出自東京大學醫科學研究所2022年06月16日的新聞發布資料)
研究團隊利用評估病毒外膜與細胞膜融合情況的膜融合分析系統,確定了萘莫司他(Fusan)等感染抑制劑。發現新冠病毒的刺突蛋白與SARS和MERS冠狀病毒的刺突蛋白不同,誘導膜融合時不依賴TMPRSS2。
為此,研究團隊利用東京大學新藥開發機構分發的現有藥物和分子靶向藥物等約3000種藥物的化合物數據庫進行了篩選,發現伊洛馬司他和CTS1027等針對金屬蛋白酶的廣譜抑制劑能有效抑制TMPRSS2非依賴性膜融合,表明某些金屬蛋白酶對新冠病毒的膜融合非常重要。
金屬蛋白酶是包括MMP(Matrix metalloproteinase:基質金屬蛋白酶)和ADAM(a disintegrin and metalloproteinase:去整合素和金屬蛋白酶)家族等在内的蛋白質水解酶的總稱,已被證實會參與實體癌的轉移和浸潤。此前為抑制癌細胞轉移和浸潤,對馬立馬司他和普馬司他兩種金屬蛋白酶抑制劑進行過臨床試驗,已確認體內服用有一定的安全性。研究人員在研究這些有望進行臨床應用的金屬蛋白酶抑制劑抑制新冠病毒通過刺突蛋白進行的膜融合的效果時發現,這些金屬蛋白酶抑制劑可以獨特性抑制TMPRSS2非依賴性膜融合。
為調查這種金屬蛋白酶依賴性膜融合在源自哪些組織的細胞中對感染比較重要,研究人員利用表達刺突蛋白的偽病毒分析了馬立馬司他在各種細胞系中的感染抑制效果。結果顯示,馬立馬司他在源自腎臟、子宮內膜和卵巢的細胞系中有效抑制了偽病毒感染,但在源自肺部和大腸的細胞系中未表現出抑制效果。也就是說,金屬蛋白酶介導的新冠病毒感染具有細胞獨特性。
另外,研究團隊為了調查高病原性冠狀病毒中只有新冠病毒的刺突蛋白才可以利用金屬蛋白酶的機制,部分更換了雖然刺突蛋白結構相似但不會利用金屬蛋白酶引起感染的SARS冠狀病毒的刺突蛋白結構,製備了具有嵌合體刺突蛋白的偽病毒並進行了比較。結果發現,要想利用金屬蛋白酶進行感染,刺突蛋白要具有在S1和S2兩個結構域的邊界處被蛋白質水解酶Furin切斷的新冠病毒源序列,並且新冠病毒的刺突蛋白C端要有S2結構域。
另一方面,為了確定靶細胞側的因子,研究團隊利用獨特性抑制劑和基因剔除法進行了分析,發現作用於細胞膜的金屬蛋白酶ADAM10起著重要作用。
此外研究人員還發現,馬立馬司他和普馬司他能在以低於之前的臨床試驗血漿濃度下抑制依賴於新冠病毒感染的細胞融合和細胞死亡。細胞融合和細胞死亡可能與COVID-19的各種病症有關,這表明了把金屬蛋白酶作為治療靶點的重要性。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
期刊:mBio
論文:Metalloproteinase-dependent and TMPRSS2-independent cell surface entry pathway of SARS-CoV-2 requires the furin-cleavage site and the S2 domain of spike protein
DOI:10.1128/mbio.00519-22
URL:journals.asm.org/doi/10.1128/mbio.00519-22













