胰島β細胞(胰島)移植已被作為根治糖尿病的方法,但移植後必須終身服用免疫抑製劑以防止排斥反應。福岡大學基礎研究機構胰島研究所的安波洋一名譽教授等人組成的研究團隊此前開發出了一種將胰島β細胞移植到皮下脂肪而不是肝臟後的方法,此次則通過實施bFGF(鹼基性纖維母細胞生長因子)處理,發現此舉可以防止人體產生排斥反應。安波名譽教授表示:「今後,我們將在食蟹獼猴等靈長動物身上進行驗證,然後再將其用於人體。」相關内容已經發布在美國糖尿病協會期刊Diabetes的電子版上。
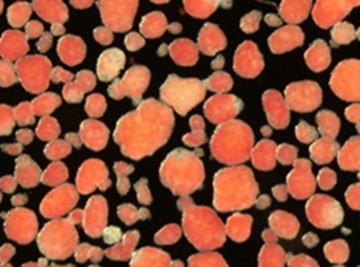
圖1:類圓形的紅色塊體為胰島,大小約為直徑0.2mm,是由約2000~3000個細胞組成的團塊。紅色為胰島素中所含鋅的染色。(供圖:福岡大學安波洋一名譽教授)
日本大約有2000萬名糖尿病患者,其中必須終身注射胰島素的重症患者據說約10~20萬人。作為不必注射胰島素的方法之一而受到關注的做法是,為糖尿病患者移植生成胰島素的胰島細胞移植。然而,為了使移植細胞在移植後存活下來並發揮功效,需要防止對移植的細胞產生排斥反應,因此移植者需要服用免疫抑制藥物,所以糖尿病患者在移植後必須終身服藥。另一方面,免疫抑製劑存在導致免疫力下降,誘發傳染病或惡性腫瘤的副作用,所以理想的解決方案是開發出能夠不需要使用免疫抑製劑的排斥反應控制法。尤其是兒童1型糖尿病,免疫抑製劑會導致發育障礙,因此無法為兒童使用。目前胰島移植尚未應用於兒童1型糖尿病。
目前的治療方法是向肝臟移植胰島β細胞,但肝臟會發生特有的早期排斥反應等,導致移植細胞的存活率低的嚴重問題。此前,安波名譽教授的研究團隊開發並報告了通過將胰島β細胞的移植部位改為皮下脂肪,可大幅提高存活率的「皮下脂肪組織内胰島移植法」。此次,研究團隊進一步改良了這種方法,開發出了不使用免疫抑制藥物的排斥反應控制法。
研究團隊使用了小鼠胰島移植實驗系統。當把從白鼠(BALB/c)體內分離出來的胰島移植到糖尿病黑鼠的腹股溝皮下脂肪組織内後發現,黑鼠的高血糖在移植胰島分泌的胰島素的作用下一時恢復了正常,但移植後10天左右出現排斥反應,移植胰島被破壞,胰島素枯竭,黑鼠再次出現高血糖。
在該實驗系統中,移植前將含藥劑(bFGF)的洋菜粉棒置於受體細胞皮下脂肪組織中兩週,然後再向該部位移植胰島發現,糖尿病小鼠的血糖在移植後不再升高,在約1年的長時間裏維持了正常血糖。移植一年後,摘除含移植胰島的皮下脂肪組織,則發現接受者出現高血糖。這個結果表明,接受者的正常血糖是在移植胰島分泌的胰島素的作用下實現的。
對摘除的組織進行顯微鏡觀察,確認是正常的移植胰島,證明移植胰島在沒有使用免疫抑製劑的情況下存活了一年以上。小鼠的壽命約為一年多,此次開發的排異控制法幫助移植胰島存活了一年以上表明,說明利用這種方法可以在不實施免疫抑制的情況下終身控制排斥反應。
研究團隊通過初步處理在皮下脂肪組織内大量誘導了產生免疫抑制因子TGFβ的間充質幹細胞,還在其他實驗中分離了通過初步處理在皮下脂肪組織内誘導的間充質幹細胞,並與分離的胰島一起移植到糖尿病小鼠體內,由此發現移植胰島無需免疫抑制藥物即可存活。此外研究團隊還確認到,一起移植的產生TGFβ的間充質幹細胞會停留在移植位置,長期控制排斥反應。
今後,將利用iPS細胞等製備胰島β細胞進行移植手術,通過同時移植產生TGFβ的間充質幹細胞,期待能夠實現不發生排斥反應的手術。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
期刊:Diabetes
論文:Acceptance of murine islet allografts without immunosuppression in the inguinal subcutaneous white adipose tissue pretreated with bFGF
DOI:10.2337/db21-0684













