大阪大學研究生院生命機能研究科的大江由佳子研究生與該校研究生院醫學系研究科的中村修平副教授和吉森保教授等人組成的研究團隊,成功明確了控制自噬過程中形成的中間體「兩性體(Amphisome)」與溶體融合的新機制。
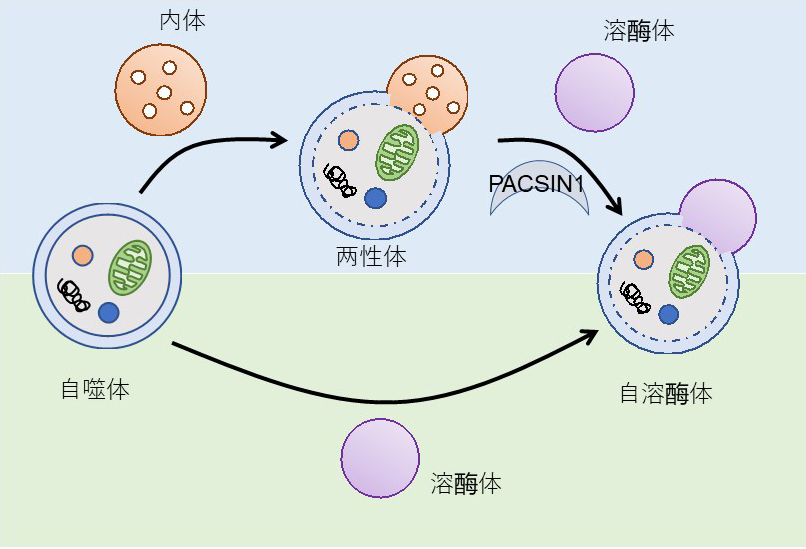
圖1:研究概略圖
自噬有兩種降解通路。其中,PACSIN1控制兩性體與溶體之間的融合(供圖:大阪大學)
自噬是真核生物中普遍存在的細胞内降解系統,已知由飢餓和壓力誘導。誘導自噬後,細胞質的各種成分會被名為自噬體的結構包圍,並運送至含消化酶的溶體中降解。已知在這個過程中存在兩種通路,分別是自噬體直接與溶體融合的通路,以及經過名為兩性體的中間體後與溶體融合的通路,但一直不清楚這兩種通路的控制機制和存在意義。
研究團隊此次發現,PACSIN1基因缺陷細胞的基底自噬活性會下降,調查其原因,發現自噬體和内體的混合結構體——兩性體與溶體之間的融合過程受到抑制。另外,PACSIN1基因缺陷細胞中出現的自噬活性下降現象在通過飢餓誘導的自噬中未出現,這表明是根據自噬誘導的刺激和降解基質的差異來區分使用兩種融合通路的。
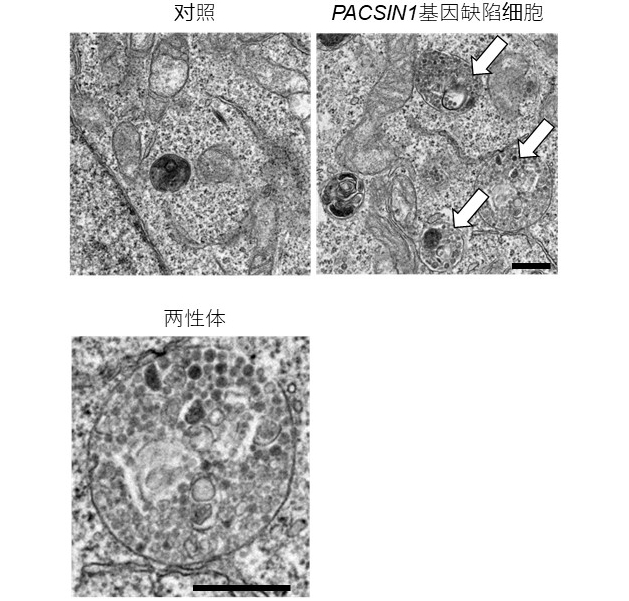
圖2:兩性體在PACSIN1基因缺陷細胞中積累(供圖:大阪大學)
上:電子顯微鏡下的細胞超細結構。與對照細胞相比,兩性體(箭頭處)在PACSIN1基因缺陷細胞中積累。下:積累的兩性體的超微細構造。比例尺:500nm。
對此,研究團隊調查了獨特性降解特定降解基質的選擇性自噬是否會區分使用這兩種通路。結果顯示,PACSIN1對於選擇性去除受損溶體的溶體自噬和選擇性去除蛋白質聚集體的聚集體自噬中都是必要的,而選擇性去除不良粒線體的粒線體自噬則不需要。
此外,為明確兩性體介導的融合路徑的生理作用,研究團隊利用線蟲和哺乳動物培養細胞調查了α-突觸核蛋白(中樞神經中豐富存在的蛋白質)聚集體的積累情況。與對照組線蟲相比,PACSIN基因缺陷線蟲的α-突觸核蛋白聚集體的積累得到增加。在使用哺乳動物培養細胞的實驗也獲得了同樣的結果。這表明,兩性體介導的自噬通路阻止了蛋白質聚集體的積累。
中村副教授表示:「此次通過調查PACSIN1的功能首次發現,自噬通路是根據降解對象區分使用的。特別是,我們還發現PACSIN1的兩性體介導的通路在降解引起神經退行性疾病的聚集蛋白方面發揮著重要作用。今後有望利用這一發現確立預防和治療神經退行性疾病的新方法。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
期刊:PLOS Genetics
論文:PACSIN1 is indispensable foramphisome-lysosome fusion during basal autophagy and subsets of selective autophagy
DOI:doi.org/10.1371/journal.pgen.1010264













