日本岐阜大學糖鏈生命核心研究所(iGCORE)的木冢康彥教授和大阪大學微生物病研究所的長江雅倫助教,與東北醫科藥科大學、產業技術綜合研究所及美國密西西比大學組成的國際聯合研究團隊,發現了與糖尿病有關的糖鏈合成酶GnT-IVa的新反應機構。GnT-IVa是負責在蛋白質的糖鏈上形成分支結構的酶,研究發現,GnT-IVa除糖鏈形成區域外,還有此前已知的糖鏈合成酶所沒有的糖鏈結合區域(凝集素)。另外,通過明確該區域的空間結構發現,凝集素對於酶活性至關重要,通過與特定糖鏈結合促進糖鏈有效合成。此次的發現將為明確蛋白質上形成複雜糖鏈的機制提供重要的基礎知識,同時還有助於明確糖尿病的病理及開發治療方法。相關内容已經發布在Communications Biology上。
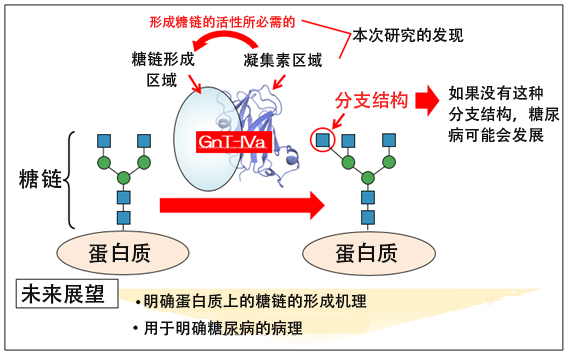
圖:本次研究的概要圖(供圖:岐阜大學糖鏈生命核心研究所的木冢康彥教授)
糖鏈主要以與蛋白質和脂質等結合的狀態存在,已知當人生病時糖鏈的形狀就會發生變化。糖鏈的變化在醫療領域被用於癌症等的診斷,此外,特定的糖鏈在癌症、阿茲海默症和糖尿病等多種疾病中都發揮著重要作用,因此有望開發靶向糖鏈的新治療藥物。
附著在蛋白質上的糖鏈是在細胞中的糖基轉移酶(糖鏈合成酶)的作用下形成的。「GnT-IVa」大約有180種人類糖基轉移酶,在細胞中作用於蛋白質上附著的N型糖鏈,形成某種分支結構。研究發現,這種GnT-IVa形成的分支結構與糖尿病的發病和發展密切相關。
另一方面,此前一直不清楚GnT-IVa自身的空間結構,以及GnT-IVa在蛋白質上形成糖鏈的機制等詳細情況。
因此,木冢教授等人首先著眼於GnT-IVa的胺基酸序列。利用蛋白質空間結構預測工具Phyre2進行調查發現,除形成糖鏈的催化結構域外,C末端還有凝集素結構域。凝集素會選擇性地與各種糖鏈結合,表明GnT-IVa會在C末端的凝集素結構域與特定糖鏈結合。由於很多醣基轉移酶都沒有這種凝集素結構域,這表明GnT-IVa是以不同於其他酶的獨特機制形成糖鏈的。
為明確凝集素結構域在GnT-IVa酶活性中的作用,研究團隊分別在細胞中表達GnT-IVa或者凝集素結構域缺損的突變體,並進行了純化。然後在試管中將純化的酶與作為基質的糖鏈混合,並利用高速液相層析圖儀分析酶反應的產物。結果顯示,去除了凝集素結構域的GnT-IVa沒有表現出酶活性。也就是說,凝集素結構域對酶活性來說是不可或缺的。
接下來,研究團隊詳細調查了凝集素結構域的功能和空間結構。凝集素結構域與糖鏈結合的可能性很高,因此以包括N型糖鏈和O型糖鏈等在内的157種糖鏈為對象,利用前緣親和力層析術調查了凝集素結構域與哪種糖鏈結合。由此發現,凝集素結構域隻與具有GnT-IVa形成的分支結構的N型糖鏈結合。
此外,研究團隊還通過X射線晶體結構分析法,明確了純化的凝集素結構域的三維結構。根據其空間結構進行分子動力學模擬發現,凝集素結構域會與具有催化結構域形成的分支結構的N型糖鏈強烈相輔作用。另外還發現,GnT-IVa的第445位氨基酸天冬醯胺酸酸(D445)對這種相輔作用非常重要。
最後,為調查GnT-IVa在細胞中實際作用於蛋白質時的凝集素結構域的作用,研究團隊把對凝集素結構域的糖鏈結合能力至關重要的氨基酸(D445)更換成丙胺酸,在細胞中表達了凝集素結構域失落功能的突變體(D445A),調查了其功能。結果顯示,為了讓GnT-IVa在細胞中的蛋白質上有效形成糖鏈,需要凝集素結構域與糖鏈結合。
木冢教授等人最近發現,形成N型糖鏈其他分支結構的酶GnT-V也是通過不同於催化結構域的其他結構域識別基質蛋白的。這些發現表明,每種糖基轉移酶都是通過獨特的機制作用於基質蛋白並形成複雜糖鏈的。另一方面,關於GnT-IVa的凝集素結構域與糖鏈的結合是如何有效促進酶反應的細節尚不清楚。今後,如果能明確包括催化結構域在内的GnT-IVa整體的空間結構,就有望進一步明確其工作機制。另外,此次的研究成果對思考一般糖鏈中尚未明確的「不同蛋白質上附著不同糖鏈的機制」也非常重要。
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
期刊:Communications Biology
論文:Discovery of a lectin domain that regulates enzyme activity in N-acetylglucosaminyltransferase-IVa (MGAT4A)
DOI:10.1038/s42003-022-03661-w
URL:nature.com/articles/s42003-022-03661-w