東京慈惠會醫科大學生物化學講座的山田幸司講師與該校内科學講座(消化器官、肝臟内科)的及川恆一講師等人組成的研究團隊,宣佈發現了一部分細胞質蛋白質從肝癌細胞的內質網釋放到了細胞外部的新型分泌機制,其中一部分血清中的「蛋白激酶C Delta(PKCδ)」可作為早期診斷得生物標誌物。經過全面的蛋白質組學解析,研究團隊發現分泌的細胞質蛋白質侷限在內質網内,明確了其與內質網内膜分子相互作用後分泌到細胞外的機制。這一現象有望成為與肝癌發病機製和早期診斷相關的研究成果。相關研究成果刊登在了國際科學雜誌《PNAS》8月31日號和《Gastro Hep Advances》8月4日號上。
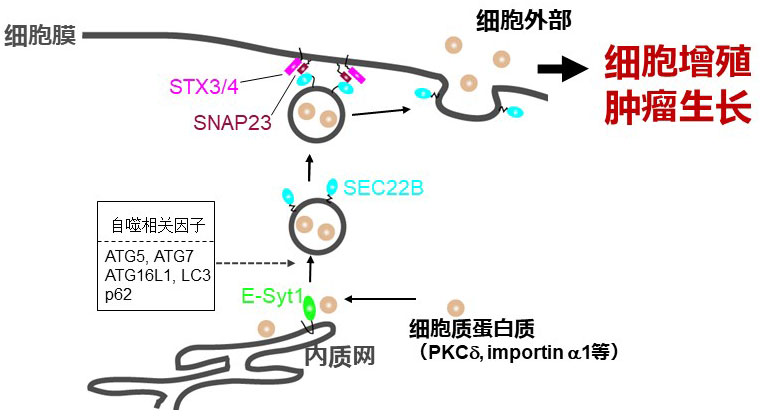
圖1. 研究概要(供圖:東京慈惠會醫科大學)
①部分細胞質蛋白質通過與內質網膜蛋白E-Syt1的相輔作用而侷限在內質網内。
②依賴於自噬因子被送入到SEC22B陽性囊泡内。
③通過作為細胞膜SNARE的SNAP23、STX3、STX4從細胞膜釋放到細胞外部。
在日本,肝癌是一種每年約有3.8萬人罹患, 其中2.5萬人死亡的疾病,病症難以顯現,且隨著病情的進展愈後也不佳。已知會經過慢性肝炎、非酒精性脂肪肝、肝硬化等階段而發病,但與其他癌症一樣,致癌機制尚不清楚。
在此之前,研究團隊已發現,在正常細胞中核轉運因子importin1和PKCδ等蛋白質停留於細胞内,而在肝癌細胞中則獨特性地分泌到了細胞外,同時還明確了這些蛋白質具有細胞增殖能力等事實。
此次研究團隊以弄清楚該分泌機制為目的,著眼於PKCδ進行了全面的蛋白質組學分析。
分析結果顯示,PKCδ通過與內質網膜蛋白E-Syt1的相輔作用而停留於內質網。由於E-Syt1的表達抑制,停留出現減少,在不分泌importin1和PKCδ等物質的胃癌細胞中則不存在這樣的停留。另外,PKCδ通過與E-Syt1的相輔作用,被與自噬相關的囊泡(SEC22B)所吸收,並通過與細胞膜的SNARE蛋白質的相輔作用被釋放到細胞膜外部。
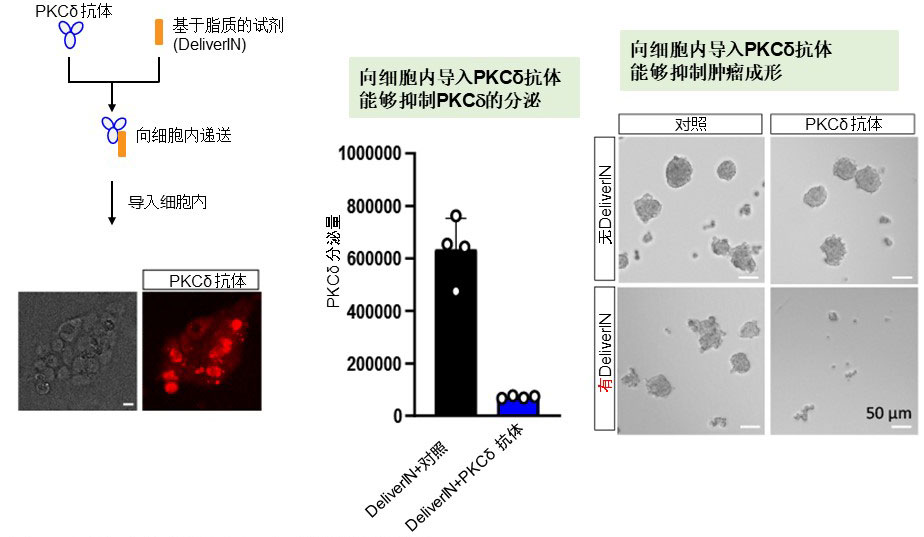
圖2. 向細胞内導入抗體而產生的抗腫瘤作用(供圖:東京慈惠會醫科大學)
通過向細胞内遞送PKCd抗體(左),抑制與E-Syt1的相輔作用,PKCd的分泌也被抑制(中)。另外,3D球狀細胞成形實驗顯示,細胞内遞送能夠明顯抑制腫瘤的成形(右),這現象將成為新藥的開發理論基礎。
研究團隊進一步將PKCδ抗體試劑遞送到細胞内,調查了其對腫瘤形成能力的影響,發現該抗體抑制了腫瘤形成。表明了其具有作為新治療靶標的可能性。
接下來,基於這些基礎研究,以肝細胞癌患者血清中的PKCδ為對象,研究了其作為肝癌早期診斷的血液生物標誌物使用的可能性。
首先,用夾心ELISA法檢測了9例健康人和313例慢性肝病(包括182例各種階段的肝癌)臨床患者的血清,驗證了其診斷能力,同時與現有的2種肝細胞癌標誌物(AFP、PIVKA2)進行了比較。
結果顯示,肝細胞癌組的血清PKCδ明顯高於健康人和慢性肝病患者組。由此可知,血清PKCδ可以作為新的生物標誌物來區分肝癌患者(以健康人為對照組)。另外,慢性肝病的血清PKCδ的肝細胞癌診斷能力與現有的標誌物基本相同。
由於血清PKCδ和現有的各標誌物沒有關聯性,因此組合使用這兩種標記物可以提高診斷性能。現有2種標誌物為陰性病例中的約半數可以通過血清PKCδ檢測出陽性來。
此外,血清PKCδ與其他2種現有標誌物不同,20毫米以下的超早期肝癌的陽性率約為45%,高於現有標誌物(各約為15%),展現出了可用於以往難以實現的早期診斷的可能性。
研究團隊今後將在推進診斷試劑盒開發的同時,對血清PKCδ與患者的臨床醫學特徵的關聯性進行解析,並以多設施共同研究的形式開展實用性驗證。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Gastro Hep Advances
論文:PKCδ Is a Novel Biomarker for Hepatocellular Carcinoma
URL:ghadvances.org/article/S2772-5723(22)00134-0/fulltext













