近日,有一項標誌著利用RNA干擾的核酸醫藥向前邁進一大步的研究結果被發布。岐阜大學研究生院聯合創藥醫療資訊研究科的特任助教杉戶信彥、特任教授赤尾幸博等人組成的研究團隊,詳細闡明瞭在大腸癌、胰腺癌中高頻度變異的RAS細胞代謝網路機制,在全球首次成功開發了阻礙RAS變異的微小核糖核酸醫藥原料。赤尾特任教授表示:「 經過20年左右的RAS研究,終於到達了開發藥物種子的狀態。目前,我們正與日本國内製藥公司共同推進有關DDS的研究,希望能在向癌細胞輸送藥物有了眉目的時候驗證其效果,開始臨床研究。」相關研究成果已經刊發在《Molecular Therapy-Nucleic Acids》雜誌電子版上。
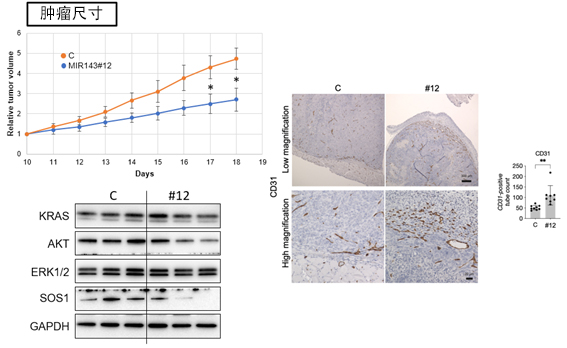
圖1 miR-143#12在小鼠模型中的抗腫瘤效果
(左上)確認了miR-143#12給藥後腫瘤尺寸的時間變化,發現與對照組相比,miR-143#12給藥組中腫瘤的增大得到了抑制。(左下)在腫瘤樣本中確認與RAS細胞代謝網路相關的蛋白質的量後,發現在miR-143#12給藥組中的表達受到了抑制。(右)通過CD31染色,確認了miR-143#12給藥組中的血管新生。
迄今為止的癌症基因體分析顯示,約30%的人類癌症中存在RAS基因的變異。特別是在大腸癌中存在變異的比例約為40%,胰腺癌則高達約90%,從而加劇了惡性化的程度。RAS通過控制超過10個下游信號形成龐大的細胞代謝網路。尤其是其中的PI3K/AKT和MAPK/ERK信號,是誘導與細胞增殖、存活相關基因轉錄的重要信號傳導路徑。
RAS抑制劑的開發在全球範圍内已進行了30多年。近年來,終於有一種僅對RAS的一種變異有效的化合物被批准成為醫藥品,但有報告稱,在臨床試驗階段已有約五成患者對其產生了抗藥性。
赤尾特任教授於2006年開始研究全面抑制RAS和RAS細胞代謝網路的微小核糖核酸(miRNA)。結果表明,使RAS系統失效的主要miRNA是miR143。miR143是一種在許多癌症組織中的表達較正常組織要低的癌症抑制miRNA。miR143通過RNA干擾,不僅以RAS為靶點,還以誘導RAS下游細胞增殖的信號系統PI3K/AKT、MAPK/ERK的AKT和ERK為靶點,具有對這些信號相互抑制的作用。然而,市售的miR143活性較弱。
杉戶特任助教和赤尾特任教授等人製備了約120種由氟、磷等進行化學修飾的miR143衍生物,從中發現了活性高且具有核酸酶抗藥性的衍生物miR143#12。
細胞水平實驗表明,#12以RAS細胞代謝網路的關鍵分子KRAS、SOS1、AKT、ERK為靶點,通過抑制整個系統發揮了較強的抗癌活性。此外,研究還發現,即使單獨抑制各關鍵分子,RAS細胞代謝網路的回饋系統也會運作,產生變異,變異型細胞會增殖,從而使#12獲得抗藥性。
研究人員將人類大腸癌細胞注入小鼠皮下,在第10天后,以160μg/kg的#12對其進行少量皮下注射,結果表明#12具有高抗癌活性,且幾乎未見其對正常細胞產生影響。此過程中還確認了大腸癌中的血管新生。對此,赤尾教授表示:「大腸癌細胞是在氧氣濃度低的地方生長的,因此有可能是血管新生破壞了恆常性,從而產生了高抗癌活性。」
微小核糖核酸在生物體內很快就會被分解,因此開發新藥需要開發DDS。赤尾表示:「我們正在與製藥企業共同研究、尋求對策,同時推進另一種方法,正在開發不被分解的構造。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Molecular Therapy – Nucleic Acids
論文:Chemically-modified MIR143-3p exhibited anti-cancer effects by impairing the RAS network in colorectal cancer cells
作者:Sugito, N., K. Heishima and Y. Akao
DOI:10.1016/j.omtn.2022.09.001
URL:sciencedirect.com/science/article/pii/S2162253122002396













