目前,將mRNA應用於疫苗以外的醫藥品的研發在全球範圍内取得了進展,但mRNA在細胞内不安定穩態則是一大難題。京都大學iPS細胞研究所(CiRA)龜田重賢博士生和齊藤博英教授等人組成的研究團隊,通過檢測微RNA(miRNA)及RNA結合蛋白,開發出了可以根據細胞種類,控制基因表現的2種環狀RNA開關,而且包含該開關的人造環形RNA可以穩定、持續地進行基因誘導。齊藤教授表示:「希望通過組合開關技術及環狀RNA技術,實現選擇性去除或再生目標細胞的mRNA藥品。」上述成果已於1月16日刊登在Nucleic Acids Research上。

齊藤博英教授(左)和龜田重賢博士生(右)(供圖:京都大學iPS細胞研究所)
使用了人工mRNA的基因導入技術,由於基因體傷害風險低,導入效率高,並且在理論上可以搭載任何蛋白質,所以不僅是疫苗,還可以應用於基因療法、基因體編輯醫療等用途。但是,由於mRNA在細胞内不穩定,導致基因表現的持續性低、並且出現在目標細胞與組織之外的基因表現也成為了課題。
研究團隊關注到的是環狀RNA。龜田博士生表示:「在使用小鼠的基因補充療法研究中,mRNA被分解,需要多次投放,副作用也很大,避免這些問題是我們開始該研究的初衷。」
一般的RNA會從末端開始分解,但環狀RNA的末端是封閉的,因此在生物體內難以分解,基因表現易於持續。然而,迄今為止還沒有控制環狀RNA蛋白表達的技術。
在生物體內,miRNA會切斷擁有互補序列的mRNA,抑制基因表達,並與RNA結合蛋白(RBP)轉錄的RNA相結合,來控制功能。二者都因細胞種類而異,並與環狀RNA和mRNA相輔作用。對此,研究團隊認為,通過模仿、改變這種相輔作用的機制,也許可以控制來自環狀RNA的基因表現,並為此設計了環狀RNA。
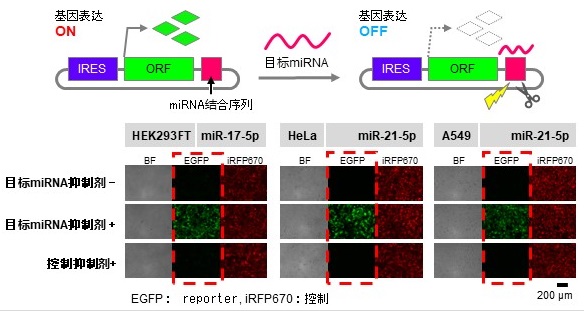
圖1 miRNA應答開關的結構及在培養細胞中的基因表現(供圖:京都大學iPS細胞研究所)
具體做法如下,首先在編碼基因的區域上游,將擁有無Cap結構也能誘導翻譯的内部核糖體侵入部位(IRES)的RNA,合成為環狀。然後,合成響應細胞内miRNA、控制基因表現的環狀RNA,並且僅在特定miRNA存在於細胞内時,才抑制基因表達。還通過在環狀RNA的基因表現所必須的IRES序列中,插入識別RBP的序列,從而實現了RBP對基因表現的抑制。也就是說,構築了兩個閉合開關。研究團隊還成功構建了結合這兩個環形RNA開關的人工基因迴路,並成功在miRNA存在的條件下激活了基因表現。
導電的迴路的輸出根據目標miRNA的量而增加,具有比普通mRNA迴路更好的基因表現持續性,在本次實驗中確認持續性高達92倍。
使用本研究開發的系統,可以在只有目標miRNA的細胞中關閉基因表現,在沒有目標miRNA和RBP時可以開啟基因表現,甚至在只有目標RBP的細胞中也可以開啟基因表現。如果將其應用於醫療,則可以在各種細胞中,選擇性去除導致疾病的癌細胞等有害細胞,或隻向特定的細胞傳送基因,使出現異常的細胞變為正常細胞。
齊藤教授表示:「此次研究,為mRNA的新醫藥應用開發了基礎技術。全球對環狀RNA的期待很高,研究開發的競爭逐漸激烈。我們也成立了生物初創企業,今後,包括實用化課題之一的DDS在内,將與不同的公司及大學等合作共同推進研發。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Nucleic Acids Research
論文:Synthetic circular RNA switches and circuits that control protein expression in mammalian cells
DOI: 10.1093/nar/gkac1252













