大阪大學研究生院藥學研究科博士研究生森田真綾、副教授岡田欣晃等人的研究團隊,通過增加具有抑制血管通滲透性功能的Robo4基因的表達量,發現了重症感染(敗血症等)小鼠的血管通滲透性亢進和死亡率下降。研究團隊還從調節Robo4基因表現的機制中,確定了能夠增加Robo4量的藥物(ALK1抑制劑),並證明該藥物可以降低肺的血管通滲透性,降低敗血症和感染了新冠的小鼠的死亡率。岡田副教授表示:「從理論上講,以血液通滲透性為靶點的治療策略由於不選擇病原體的種類,所以有助於對新出現的未知感染症開發治療藥物。今後,我們將在推進最佳分子設計的同時,與企業展開共同研究。」該研究成果已發表在《Proceedings of the National Academy of Sciences》上。
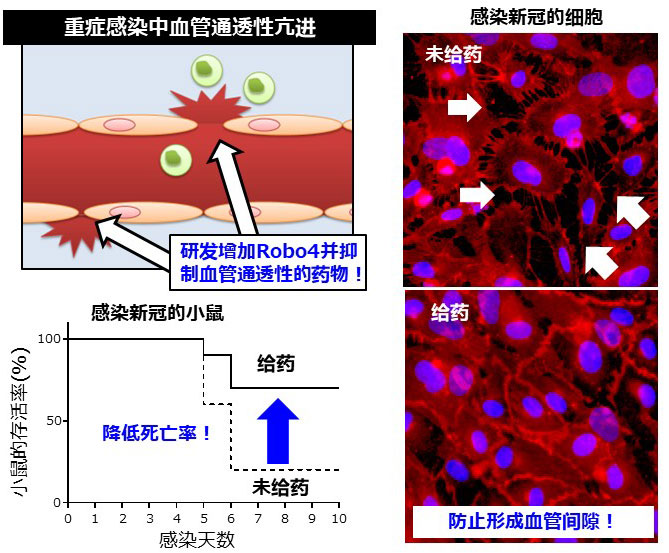
圖1血管通滲透性抑制劑與新冠的治療效果(供圖:大阪大學)
當病原體侵入體內時,免疫細胞被激活並產生炎性細胞介素。血管內皮細胞是通過血管內皮鈣黏蛋白結合的,由於血液的炎性細胞介素刺激,血管內皮鈣黏蛋白之間的結合發生分離,血管通滲透性因此增高。這是一種讓免疫細胞更多地在體內循環的機能,但如果血管通滲透性過高,就會導致肺炎、肺水腫、敗血症、多器官耗竭等疾病。
Robo4是一種在血液內皮細胞中獨特性表達的蛋白質,能在發炎時使血管內皮細胞穩定,降低通滲透性。此前研究團隊已證實可通過Robo4的量來控制血管通滲透性,無Robo4的小鼠血管通滲透性會亢進,患敗血症的死亡率也會增高。
研究團隊認為增加Robo4的量可以抑制血管通滲透性,從而治療重症感染,並對此展開了研究。
研究團隊首先製備了Robo4過度表達2~3倍的小鼠,確認了其肺的血管通滲透性與野生小鼠相比受到了抑制。研究團隊還將細菌的膜成分——脂多醣向小鼠給藥,誘發敗血症,結果顯示野生小鼠死亡率為9成以上,而過度表達的小鼠死亡率降至45%左右。
為闡明控制Robo4量的機制,研究團隊製作了表達Robo4時會發光的細胞,從化合物庫中登記的2000多種化合物中尋找改變Robo4的藥物並分析結果後,發現ALK1通過SMAD1/5使Robo4減少。此外還發現了化合物K02288會抑制ALK1。
接下來,研究團隊分析了ALK1抑制劑能否緩解小鼠敗血症的病情,發現ALK1抑制劑能增加小鼠肺的Robo4量,並抑制敗血症小鼠肺血管的通滲透性。此外,通過使用ALK1抑制劑,敗血症小鼠的死亡率從80%以上下降至45%左右。
研究團隊使用CiRA研發的呼吸道晶片對新冠病毒的血管通滲透性進行分析,結果表明,ALK1抑制劑可將由呼吸道通道進入到血液通道的病毒通過量減至三分之一左右。此時,在注射了ALK1抑制劑的血管通道中,病毒引起的細胞粘著破壞得到抑制。此外,給感染新冠的小鼠注射ALK1抑制劑後,病毒對肺部的損害減輕,死亡率從9成降至3成。
希望助力預防藥物的研發
岡田副教授表示:「此次雖然看到了病情的預防效果,但我們還想確認重症化之後的治療效果,以及與其它治療藥物合用能否進一步降低死亡率等問題,進而確認能否廣泛適用於敗血症和新冠以外的感染。此外,還希望推動研發出藥物,在感染後服用能預防性地強化血管,預防重症化。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Proceedings of the National Academy of Sciences
論文:Upregulation of Robo4 expression by SMAD signaling suppresses vascular permeability and mortality in endotoxemia and COVID-19 models
DOI:10.1073/pnas.2213317120













