通過更易於使用的低分子藥,達到與使用了RNA(核糖核酸)等的「核酸醫藥」同等效果的研究正在推進之中。美國斯克利普斯研究所開發的名為「RIBOTAC(核糖核酸酶靶向嵌合體)」的技術,就是利用低分子來分解疾病根源RNA的,動物實驗確認了其對癌症和ALS(肌萎縮性側索硬化症)的效果。2名日本人為該技術的開發做出了貢獻,日本國内企業也開始探討該技術。

開發成功RIBOTAC的美國斯克利普斯研究所的馬修·迪士尼教授(左)和田邊三菱製藥的松本安正主任研究員(提供:田邊三菱製藥)
核酸醫藥近年來應用越來越多,為遺傳性疑難病症等的治療帶來了新機遇。核酸醫藥的原理是作用於從DNA克隆遺傳資訊RNA,並抑制目標基因的影響。治療中使用的人工核酸優勢在於,易於根據病症設計,可以在短時間内合成新藥候補。但由於分子較大,要將其輸送到患部,需要花費一番努力,同時可作為對象的臟器也有很多制約。
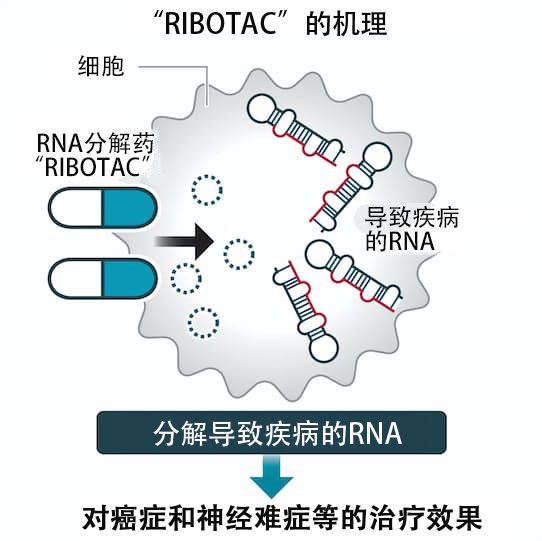
RIBOTAC是比核酸更容易作為藥劑使用的低分子藥,同時可以發揮與核酸醫藥同等的作用。其原理是,在細胞内分別與分解RNA的酶及致病的RNA相結合,使二者接近並促使其分解。與核酸藥物相比,RIBOTAC的設計難度更大,但理論上可以輸送到所有器官,不僅可以用作點滴藥,也可以製成口服藥。這是斯克利普斯研究所教授馬修·迪士尼等人於2018年發表的技術。
「RIBOTAC能克服核酸醫藥的缺點」。參與開發的田邊三菱製藥的松本安正主任研究員也為這項技術做出了貢獻。
松本安正主任研究員感受到了作用於蛋白質的傳統藥物的侷限性,並於2016年到2018年到RNA研究第一人的迪士尼教授身邊留學。他成功合成了分解與癌症增殖相關的MicroRNA這種低分子,並在有效治療藥物較少的乳房癌細胞上確認了效果。
研究的出發點,是作為分解蛋白質的治療藥進行開發的「PROTAC(蛋白降解靶向聯合體)」。二者都是利用了細胞所具備的分解機制的低分子藥,而問題是如何將分別與MicroRNA及RNA分解酶結合的分子連結起來。化學合成專業的松本主任研究員花了大約半年的時間成功解決了這一問題。
另一位從2018年到2021年在迪士尼教授身邊學習的是東京大學的相川春夫助教。他將與RNA分解酶相結合的分子小型化,使其更易於在生物體內發揮作用,並在小鼠實驗中抑制了癌症向肺部的轉移。
相川助教等人證實了這項技術應用於肌肉逐漸僵化的疑難病症ALS上的可能性。ALS被認為是由特定基因的RNA中發現的鹼基反復序列引起的。一般的反覆在20次左右,而超過100次就會引發病症,在RNA中形成髮夾狀結構,在細胞内結塊,從而使神經細胞受損。研究人員通過合成與該結構結合併分解RNA的化合物,成功減少了小鼠細胞内的結塊。
RIBOTAC與核酸醫藥相比,還有減少副作用的可能性。在ALS中發現的鹼基反復序列中,長度較短的序列也存在於另一個基因的RNA中。核酸藥物也會作用於這樣的RNA,而RIBOTAC只會分解使ALS發病的RNA。核酸藥物作用於鹼基序列,而RIBOTAC作用於RNA結構。RIBOTAC「能超越核酸醫藥的界限」(相川助教)正是因為它的這個特徵。
日本國内企業也開始了相關開發。RNA製藥公司veritasinsilico(VIS、東京・品川區)於2022年宣佈,將與對藥品開發提供支持的Axcelead Drug Discovery Partners(ADDP,神奈川縣藤澤市)共同開發探索RIBOTAC化合物的技術。VIS的中村慎吾社長表示:「希望能夠開發出效果更好的化合物。」
用於RIBOTAC的化合物等「要素」正逐步齊全。雖然這還是一項處於黎明時期的技術,但它隱含著能極大程度改變藥品開發方式的可能性。
日文:遠藤智之、《日經產業新聞》、2023/2/8
中文:JST客觀日本編輯部













