東京大學的岡本晃充教授等人,開發了一種能夠選擇性殺死癌細胞的人工DNA。並在小鼠和細胞實驗中對多種癌症獲得了效果。該成果有望成為使用DNA和RNA(核糖核酸)的「核酸醫藥」新候補,並有可能發展成為副作用少的癌症治療方法。目前研究團隊已設立了初創企業以推動其實用化,併計劃在數年後開始臨床試驗。

開發出了殺死癌細胞的人工DNA(供圖:東京大學岡本晃充教授)
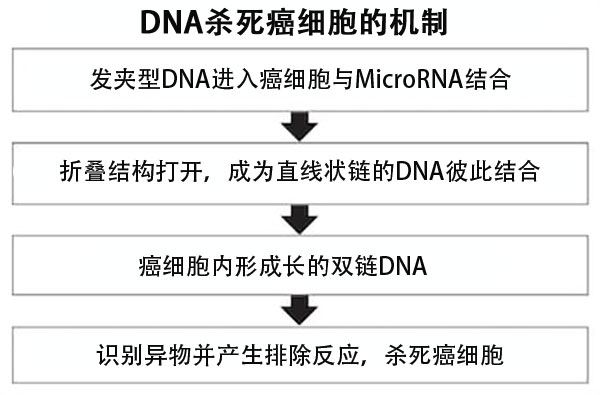
癌細胞會根據臟器等,過度表達名為MicroRNA的特定類型遺傳資訊物質。研究團隊關注到像髮夾一樣具有彎曲結構的DNA會以MicroRNA為標誌,形成長的雙鏈結構,遂開始思考能否設計出一種DNA,進入癌細胞内部製作雙鏈結構,並引發將癌細胞作為異物排除的免疫反應。
當進入癌細胞的髮夾型DNA結合在MicroRNA上後,摺疊結構被開啟,DNA會變成直線狀的鏈,並且成對的髮夾型DNA會在這裏相結合。這樣DNA反復結合後,形成長的雙鏈。
實驗結果發現,這種狀態會引發排除異物的免疫反應,將癌細胞逼向死亡。「與以往抗癌劑不同的結構,可能會對現有藥物無法起效的癌症也發揮效果。」(岡本教授)
研究團隊在小鼠上也確認了實際效果。給6隻患有皮膚癌之一的惡性黑素瘤的小鼠注射了新開發的DNA後,所有小鼠的腫瘤都沒有變大。對於宮頸癌和現有藥物難以奏效的乳房癌,研究團隊也在細胞實驗中確認到了效果。
不同類型的癌症其表達的MicroRNA也不同,可以相應地設計DNA。在小鼠和細胞實驗中,研究團隊首先將其結合在了多種癌症共通的MicroRNA上。將來有可能採用通過手術取出腫瘤、調查MicroRNA類型、並選擇相應DNA的治療方法。
在使用傳訊RNA(mRNA)的新型冠狀病毒疫苗等核酸醫藥備受關注的背景下,也曾出現過使用DNA製作癌症治療藥物的想法。但是,以往的人工DNA很難瞄準特定的細胞進行攻擊,因為有對全身產生副作用的問題,因此研究並沒有進展。此次開發的DNA,會結合在僅在癌症中過度表達的MicroRNA上,因此有望降低對正常細胞的傷害。
該技術可以通過化學方法低成本製造,並且從設計到合成、毒性評價這一系列工序所需的時間也很短。研究團隊已在2022年4月成立了東京核酸合成公司(東京·文京區),以推進此項技術的實際應用,併計划進行安全性等驗證,幾年後實施第一階段的臨床試驗。
日文:藤井寬子、《日經產業新聞》、2023/2/6
中文:JST客觀日本編輯部













