京都大學研究生院藥學研究科和醫藥基礎/健康/營養研究所(NIBIOHN)的聯合講座/實務創藥研究項目的金尾英佑助教、石濱泰教授、足立淳聯合教授等的研究團隊與該校研究生院工學研究科的久保拓也副教授、大冢浩二教授、和田俊太郎研究生(研究當時)等的研究團隊、以及秋吉一成教授等的研究團隊,聯合開發出了海綿狀聚合物分離介質,通過識別結合在從細胞放出的微粒子——外泌體表面的糖鏈,對外泌體進行分類,並發現即使是來自同一細胞的外泌體,其表面糖鏈的作用也各不相同。
圖1 本次研究構建的海綿整體材料分離外泌體示意圖(供圖:京都大學)
已知的糖鏈分離方法,是將糖鏈識別蛋白質質(研究中為凝集素)用於固定相的LAC(凝集素親和力層析術),但由於傳統LAC用分離基材的中孔較小,外泌體這樣的微粒子比中孔要大,會出現堵塞,無法穿過現象。
研發團隊獨立開發出了大於以往10~100μm通孔尺寸的大通孔高透水性海綿狀聚合物分離基材(海綿整體材料),並用作為LAC分離基材,解決了這一難題。研究團隊以具有口水酸識別能力的日本接骨木凝集素(SSA)和具有甘露糖識別能力的刀豆蛋白A(ConA)為模型,製作出了固定各個凝集素的海綿整體材料,從培養細胞(HEK293細胞)中通過超離心法分離收集到了外泌體亞類。在不破壞形狀的情況下,成功地完整收集了對應於每種凝集素的特定表面糖鏈外泌體。
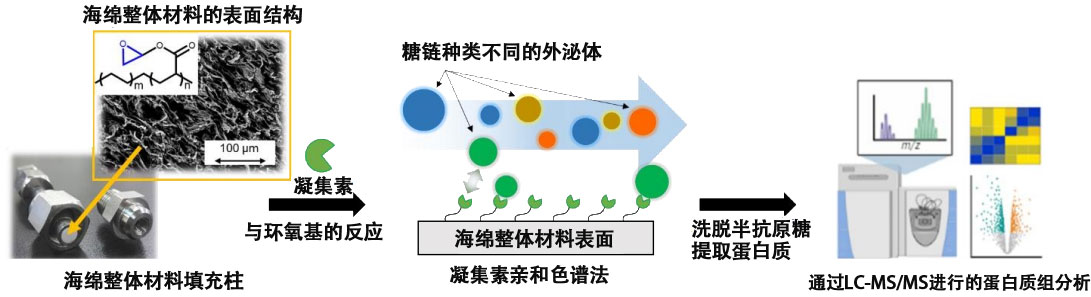
圖2 研究概要。刊登於《Analytical Chemistry》的圖片。(供圖:京都大學、Copyright 2023 American Chemical Society)
另外,研究團隊通過蛋白成分析發現,通過SSA收集到的外泌體和通過ConA收集到的外泌體構成的蛋白質及其功能有很大不同。
金尾助教表示:「傳統的分離基材通孔小,不適合分離外泌體這樣的較大結構體,但我們通過在分離基材中應用獨立開發的多孔性海綿狀聚合物克服了這一問題。此成果有可能成為創藥研究中分享外泌體的基本技術,且有望通過應用,創造出可以分離以病毒為代表的所有生物粒子的分離平台。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Analytical Chemistry
論文:Classification of Extracellular Vesicles Based on Surface Glycan Structures by Spongy-like Separation Media
DOI:doi.org/10.1021/acs.analchem.2c04391













