CRISPR-Cas9作為一種可以自由編輯各種細胞的靶向基因的革新性技術,極大地推動了基礎研究的發展,同時在醫學領域的應用也備受期待。然而,傳統方法無法避免由過度切割基因體引發的非目標基因體位點的脫靶突變和細胞毒性等風險。九州大學生體防禦醫學研究所的川又理樹助教、木村亮太(研究當時為碩士研究生)、鈴木淳史教授以及名古屋大學大學院醫學系研究科的鈴木洋教授組成的共同研究團隊開發出了一種可自由微調基因體切割活性的新技術,成功構築了能將安全性和準確編輯效率提高數百倍的新一代基因編輯平台。川又助教表示:「這項技術可以精確控制DNA的切割與否。已經證實了可以應用於Cas9以外的領域,目前美國成立初創公司(One Genomics, Inc.)正在推進其實用化進程。」研究成果已發表在《Nature Biomedical Engineering》雜誌上。
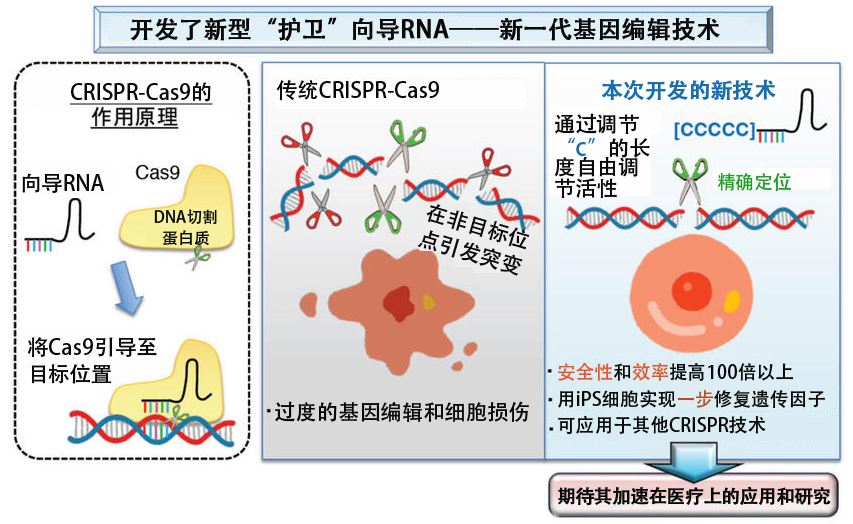
圖:此次開發的基因編輯新技術概念圖(供圖:九州大學)
雖然CRISPR技術在海外已用於基因療法,但由於現有的CRISPR工具尚未針對人類細胞基因編輯進行最適化,因此在接受CAR-T癌症治療的患者中出現了染色體易位現象,接受肌肉萎縮症治療的患者中也出現了死亡案例。
川又助教等人此前曾錯誤設計DNA親合力較弱的gRNA(向導RNA)時,根據有效獲得精確編輯細胞的經驗,認為按照現有的編輯方案,Cas9的DNA切割活性過剩,從而導致了各種問題的產生,所以決定開發可自由調節Cas9活性的新技術。
研究團隊首先在小鼠ES細胞上構建了可以通過螢光標記分別評估來自父母染色體的Cas9活性(隨機鹼基插入或缺失)的AIMS系統(Allele-specific Indel Monitor System)。通過AIMS測量使用常規gRNA時的Cas9活性,發現99.4%發生了基因缺失或隨機插入。
通過使用AIMS,研究人員探索了能夠抑制Cas9高活性的gRNA修飾方法,發現在5'端添加多個額外的胞嘧啶可以起到抑制過度活性的作用。胞嘧啶鏈越長,gRNA:Cas9復合體與靶DNA的結合能力(親合力)就越低,切割能力也越低,細胞内攝取的gRNA量也越少。由此開發出一種通過調整胞嘧啶鏈的長度便可以階段性地抑制Cas9活性的非常簡便的精細調節系統——護衛gRNA。
研究人員分析了階段性抑制活性對單個等位基因編輯模式、同源性重組修復(HDR)介導的精確編輯效率以及細胞毒性平衡的影響。結果表明,可以避免細胞毒性,提高從兩個等位基因中選擇一個進行編輯的效率,並且可以抑制脫靶,從而大幅提高HDR的效率。此外,這些效果可以獲得非HDR等位基因無傷害的報告基因等敲入細胞,實現一步即可完成單等位基因1鹼基的編輯以及製作和修復異型SNP疾病模型。
異型SNP疾病模型的基因體編輯是一種難度極高的基因編輯技術,它需要在兩個具有相似序列的基因體等位基因中,僅對其中一個等位基因導入1鹼基的突變,而另一個等位基因保持不變。事實上,研究人員已成功製備出能忠實再現發病率為200萬分之一的超罕見疾病(FOP)基因型胚胎幹細胞小鼠模型。此外,他們還能夠在FOP患者來源的iPS細胞中精確修復導致疾病的等位基因SNP,展示了其作為安全高效基因療法法的潛在價值。
同時,通過結合AIMS和大規模實驗數據以及數學模式,研究人員首次成功揭示了對於如單鹼基更換的精確編輯等各種基因體編輯用途所需的最佳Cas9活性及其規律。這使得在各種基因體編輯實驗中,可以根據不同的目標模擬最佳的Cas9活性,通過使用最佳的護衛gRNA,實現最安全、有效的基因體編輯。
另外,研究人員還證實了護衛gRNA不僅適用於Cas9,還適用於Cas12a(Cpf1)以及CRISPRa/i(激活/干擾)等基因體和表觀基因體的編輯調控。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Nature Biomedical Engineering
論文:Optimization of Cas9 activity through the addition of cytosine
extensions to single-guide RNAs
DOI:10.1038/s41551-023-01011-7













