京都大學iPS細胞研究所(CiRA)臨床應用研究部門的池谷真副教授和Denise Zujur研究員的研究團隊,與佐賀大學醫學部附屬再生醫學研究中心的中山功一教授、味之素公司等共同合作,確立了一種使用iPS細胞經過神經嵴細胞製作的間充質幹細胞(iMSC)生成軟骨球體(軟骨細胞簇)的方法。研究團隊通過添加低分子化合物,更有效率地將iMSC誘導為軟骨細胞。將所獲得的軟骨球體移植到免疫缺陷小鼠體內之後,發現繼續保持了軟骨狀態,沒有逆分化或肥大化的跡象。通過該方法獲得的軟骨球體具有數日内相互融合的特性,可獲得更大的軟骨組織。該方法有望應用於軟骨修復治療。相關研究論文已於5月10日發表在國際學術期刊《Frontiers in Cell and Developmental Biology》上。
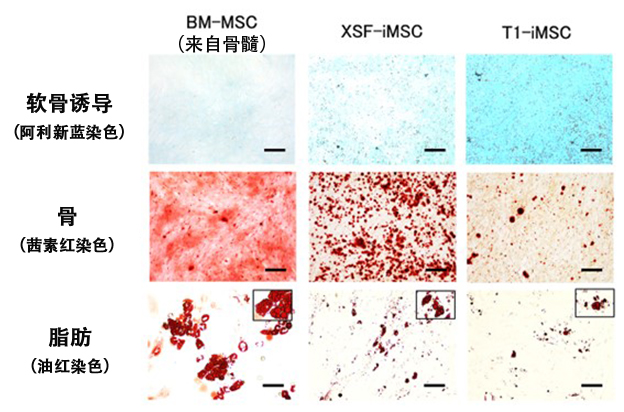
圖1 各種MSC的軟骨分化潛能比較(供圖:京都大學)
軟骨組織的阿利新藍染色結果。可見T1-iMSC藍色最深,表明其被充分分化為軟骨(上段)。基本未見分化成骨骼和脂肪(中間/下段)。(圖中比例尺為100μm)
關節軟骨起著使關節靈活運動的作用,但由於沒有血管,一旦傷害後就無法自愈,還會引起關節疼痛和畸形從而導致四肢功能障礙。對於緩解疼痛和重新獲得行走功能來說,更換為用金屬或塑料製成的人工關節是最常見也是非常有用的治療方法。然而,出於耐久性的考慮,對於年輕人和運動愛好者來說,植入人工關節需持謹慎態度。另一方面,從患者身體提取細胞進行培養再移植回患者體內的再生醫療雖已投入實際應用,但目前還僅實現了很小範圍内的部分再生,人工關節適用的大範圍軟骨缺損和骨關節炎等疾病的用途,由於存在來自原始細胞的並發症、增殖能力有限以及逆分化等問題,在日本和海外都尚未投入實際應用。 因此,利用iPS細胞生成高品質軟骨細胞的技術備受期待。
研究團隊去年成功開發出了在不含動物來源成分的條件下,通過神經嵴細胞從iPS細胞生成iMSC的技術。此次則以該技術為基礎,確立了從iMSC生成軟骨組織的技術。
首先,為了製備iMSC,研究團隊與味之素公司合作,採用了一種不含動物來源成分的新型T1培養基。研究人員分別使用不含動物來源成分的T1培養基、市售的XSF培養基製作的iMSC以及骨髓來源的MSC,比較了這三種類型的MSC對於軟骨、骨骼和脂肪的誘導效率。結果顯示,與其他兩種相比,使用T1培養基製備的iMSC具有更高的軟骨細胞誘導效率,而對骨骼和脂肪的誘導效率較低。
為了進一步提高對軟骨的誘導效率,研究團隊考慮採用分階段改變培養成分來分化為軟骨球體的「三步誘導法」,並與傳統方法進行比較。此外,還研究了已經有報告確認可以促進向軟骨分化的添加低分子化合物(TD-198946)的方法。具體採用在三步誘導法的最後一步添加TD的培養方法,以及從開始到結束都用同樣的含有TD的培養基的原有方法,相互比較了誘導生成軟骨球體的情況。結果發現,與原有的方法相比,三步誘導法在關節軟骨標誌物(PRG4)的表達上更高,而肥大軟骨標誌物(COL10A1)的表達較低,可以誘導出高品質的軟骨球體。使用該方法生成的軟骨球體的直徑約為0.5毫米。
此外,對於使用T1培養基製備的iMSC和骨髓來源的MSC、通過三步誘導法誘導生成的兩種軟骨球體,分別移植到免疫缺陷小鼠的皮下,並在8周後觀察其是否能夠保持穩定。軟骨要能發揮作用,就必須在移植後仍保持軟骨球體的狀態。結果顯示,使用T1培養基製備的iMSC誘導的軟骨球體依然能保持為軟骨組織。而骨髓來源的MSC誘導的軟骨球體除了軟骨組織外還觀察到了鈣化和類骨組織。
另外研究團隊還發現,使用T1培養基以三步誘導法生成的軟骨球體具有靠近時會相互粘附的特性,7天后會完全融合在一起。這種特性有利於製作用於移植的大塊軟骨組織。
軟骨細胞在發育過程中有兩條分化路徑,一條是經過神經嵴細胞分化,另一條是經過中胚層分化,而神經嵴細胞隻在脊椎動物中被保留了下來。
池谷準教授說:「我們這次製作的軟骨球具有與相鄰軟骨球粘附的特點,第一天開始粘附,到第四天就幾乎看不到粘接面。利用這一特點,我們將利用與我們合作研究的中山教授開發的劍山法生物3D列印機,首先的目標是構建釐米級大小的軟骨細胞組織。該列印機可以調節軟骨細胞的形狀等,如果能夠構建大塊的軟骨組織,將有望治療大範圍的傷害。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
發表期刊:《Frontiers in Cell and Developmental Biology》
論文標題:Enhanced chondrogenic differentiation of iPS cell-derived mesenchymal stem/stromal cells via neural crest cell induction for hyaline cartilage repair
DOI:10.3389/fcell.2023.1140717













