日本東海大學醫學部尖端醫療科學的幸谷愛教授、宮竹佑治特任助教、研究生院研究生龜田和明(研究時)、栁谷稜獎勵研究員、株式會社Perseus Proteomics(PPMX公司)等組成的聯合研究團隊發現了侵襲性NK細胞白血病(ANKL)在肝血竇微血管中依賴於轉鐵蛋白(Tf)增殖,同時發現獨特性抑制其接受者TfR1的抗體藥物PPMX-T003對ANKL具有顯著的抗腫腫瘤活性。計劃從今年開始啟動以ANKL患者為對象的醫師主導臨床試驗。相關研究成果已發表在《blood》線上版上。
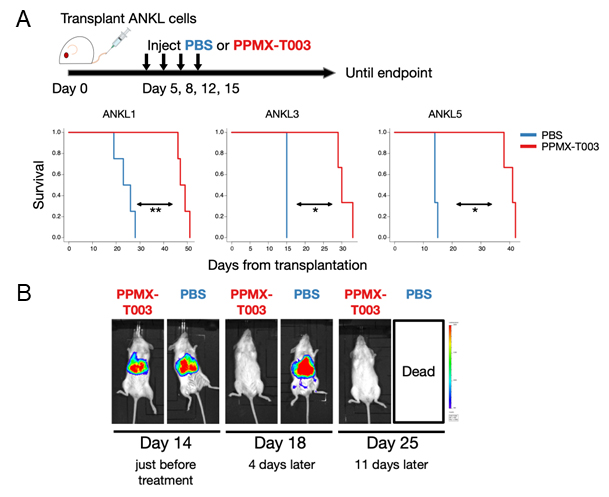
圖:PPMX-T003成功使ANKL PDX小鼠肝臟的癌細胞消退,延長了小鼠存活期(供圖:東海大學)
(A)對3隻ANKL PDX小鼠在建立PPMX-T003或不含有效成分的環域分析液(PBS)後的第5、8、12、15天内,分別靜脈注射10mg/kg並分析了存活期。結果表明,PPMX-T003治療組(紅)與未治療組(藍)相比,存活期明顯延長。(B)使用導入了螢火蟲螢光酵素基因的ANKL1細胞,在使癌細胞發光的狀態下,在PDX小鼠建立後的第14天、第17天、第21天、第24天中進行PPMX-T003 10mg/kg的靜脈内給藥治療,隨著時間的推移確認了癌細胞的量。給藥後,肝臟中顯示癌細胞的發光迅速消失。
ANKL一般在青兒少時期發病,發病後的存活期僅為兩個月左右(中間值),是一種預後極差的血液癌症。在日本每年約有10人發病,是一種罕見疾病,目前尚未建立標準的治療方法。
為了延長存活期,必須盡快實施同種造血幹細胞移植,而成功移植需要在移植前充分減少癌細胞。目前對ANKL「相對有效」的抗癌藥物被認為只有L-天冬醯胺酸酶,但該藥物有時會引起嚴重的肝傷害。許多ANKL患者的肝臟已經受到癌細胞的嚴重傷害,無法再承受治療所需的劑量。因此,無論是減少劑量或是必須放棄使用本身,都處於無法充分減少癌細胞的困境。
因此,有必要克服ANKL造成的肝傷害。為此,不僅需要單純地在培養基上測試癌細胞,還需要確定癌細胞在實際中是如何在肝臟中存活及增殖的。
研究團隊將從3名ANKL患者身上採集的癌細胞移植到免疫缺陷小鼠體內,建立了ANKL PDX模型小鼠。一段時間後對這些小鼠進行解剖並對各個器官中的癌細胞進行分析後發現,癌細胞早期在肝臟中存活和增殖,在後期擴散到全身的器官。
當在顯微鏡下觀察肝癌細胞時,發現尤其在肝臟中攝取和排出營養成分和礦物質等的血竇微血管中增殖較多。由此,研究人員認為ANKL的增殖依賴於肝臟中交換的某種物質。
研究人員利用新一代測序儀對癌細胞和周圍的肝臟細胞分別表達和分泌了哪些分子進行了網羅性調查,在其中檢索了肝臟和癌細胞之間有可能進行分子之間的結合和物質交換的配對。
結果發現,在肝臟側表達的Tf和接受Tf的ANKL側接受者分子TfR1的配對出現達到峰值。Tf是鐵離子的轉運蛋白,主要通過與TfR1結合被攝入細胞内。特別是,由於Tf在肝臟中產生最多,證明了ANKL癌細胞特別在肝血竇中增殖的原因之一是需要通過Tf和TfR1對接受鐵離子的供給。
實際上,當通過敲除ANKL癌細胞側表達的TfR1,建立ANKL PDX小鼠後,發現癌細胞在肝臟内的增殖活性顯著失落,證實ANKL在肝血竇内可以通過從肝臟側接受Tf增殖。
因此,研究團隊向已經生產了TfR1抑制抗體的PPMX公司發出聯合研究邀請,並探討了抑制抗體PPMX-T003能否真的成為ANKL的有效治療藥。首先,將來自3名ANKL患者的癌細胞在含有PPMX-T003的培養基中培養48小時,並測定了存活細胞。結果發現,癌細胞的存活能力根據PPMX-T003的濃度而降低。
在模式建立後的第7天對PDX小鼠進行單次靜脈注射,一週後通過觀察白血球中癌細胞的比例評估了癌細胞的增殖程度。結果發現,當給予3mg/kg或更多劑量時,癌細胞的增殖能力顯著降低。
最後,作為實際治療的模擬,對ANKL PDX小鼠進行多次靜脈注射,並驗證了存活期是否存在差異。結果表明,存活期延長了約1.5至2倍。這種延長效果在症狀進一步惡化的ANKL PDX小鼠(建立後第14天)的給藥中也得到了同樣的效果。
用導入了螢火蟲螢光酵素基因的PDX小鼠對治療前後肝臟内的癌細胞的量如何變化進行量化後發現,在治療前肝臟區域觀察到明顯的發光,但進行治療後發光迅速消失。
基於以上成果,研究團隊計劃於2023年在東海大學、東北大學、岡山大學、京都大學、九州大學和廣島大學啟動以ANKL患者為對象,驗證PPMX-T003的有效性和安全性的醫師主導臨床試驗(第Ⅰb/Ⅱ期試驗)。研究團隊表示,未來,在不斷推進臨床試驗的同時,將對證實ANKL高度鐵依賴的病態生理進行進一步分析。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:blood
論文:Hepatic niche leads to aggressive natural killer cell leukemia proliferation through transferrin-transferrin receptor 1 axis
DOI:doi.org/10.1182/blood.2022018597













