抗癌藥物通過誘導癌程式性細胞死亡(Apoptosis)而發揮治療作用。然而,具有抗藥性的癌症或轉移性癌症等,會對現有的以程式性細胞死亡為靶向的抗癌藥物產生抗藥性,但對鐵死亡(Ferroptosis)變得脆弱。因此,以誘導癌細胞發生鐵死亡或提高細胞鐵死亡敏感性為目標的癌症治療藥物開發受到了全球的關注。近日,日本東北大學的三島英換非常勤講師(德國亥姆霍茲慕尼黑研究中心的高級研究員)和亥姆霍茲慕尼黑研究中心博士生中村俊崇在《Nature》雜誌上分別發表了關於鐵死亡的論文。
研究概要(供圖;東北大學)
鐵死亡是細胞内脂質氧化過度導致細胞膜破裂而發生的細胞死亡,於2012年由Brent R Stockwell博士發現。作為生物體內存在防止過量脂質氧化,抑制鐵死亡的機制,也即麩胱甘肽過氧化物酶(GPX4)通路和鐵死亡抑制蛋白1(FSP1)通路。阻礙這兩條通路便可誘導鐵死亡,但GPX4在結構上缺乏與抑制劑結合的合適位點,抑制後對正常細胞也有影響。另一方面,FSP1基因剔除的小鼠仍可正常發育,因此預計不會產生嚴重的副作用,抑制劑結合位置也有多個。
三島和中村所在實驗室的Conrad博士等人首先開發出了FSP1抑制劑iFSP1,但該藥劑在體內不穩定,多以在動物體內無法發揮預期的效果。
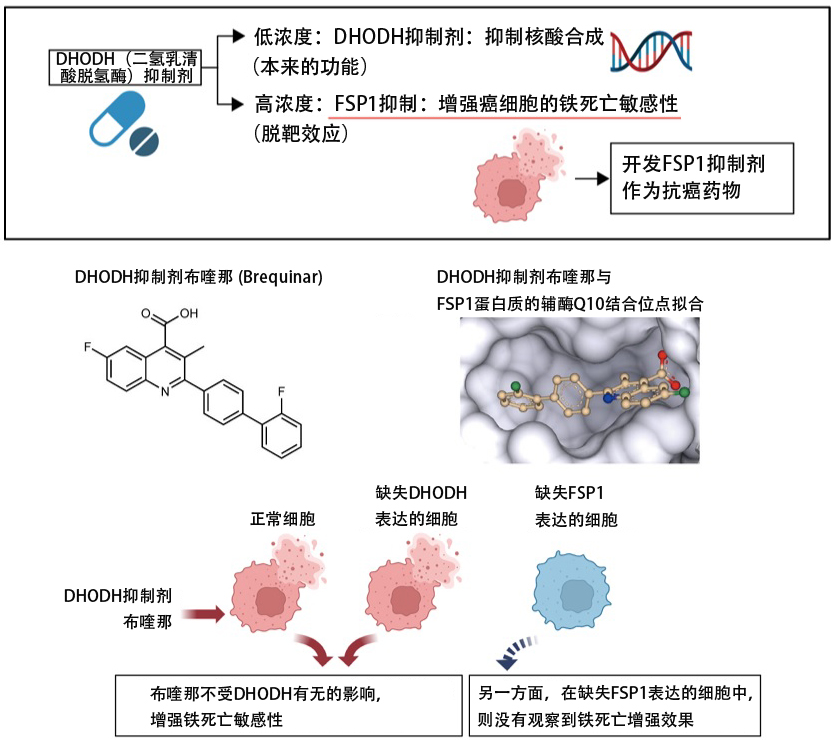
三島闡明瞭能提高癌細胞鐵死亡敏感性的DHODH抑制劑的作用機制。DHODH是合成核酸所必需的酶,DHODH抑制劑之一的布喹那,作為針對白血病等抑制癌細胞增殖的抗癌藥物正在進行臨床試驗。有報導顯示,DHODH通過還原粒線體内的輔酶Q10抑制鐵死亡。但是,在本次的研究中發現,要想發揮布喹那提高鐵死亡敏感性的效果,所需的劑量需要比在人類細胞和小鼠的實驗中抑制DHODH作用所需的劑量高100倍以上。由於布喹那和iFSP1有部分相似的結構,三島推測「這可能是脫靶效應」,並對此進行了研究。
在試管中混合FSP1和藥物,評價酶活性時發現,布喹那在高濃度時也能抑制FSP1。另外,在結構預測分析中也發現,布喹那可以與FSP1的輔酶Q10結合位置擬合。相反,在敲除FSP1表達的細胞中,則沒有觀察到布喹那增強鐵死亡的效果。此外,其他DHODH抑制劑也證實了同樣能提高癌細胞鐵死亡敏感性的效果。也就是說,DHODH抑制劑在高濃度時也是FSP1抑制劑,並且通過抑制FSP1來提高癌細胞的鐵死亡敏感性。
中村發現了一種新的FSP1抑制劑icFSP1,並確認了它具有促進鐵依賴細胞死亡的作用。利用抑制FSP1就會產生鐵死亡的FSP1表達GPX4缺失細胞,對約一萬種化合物進行篩選,從中確定了icFSP1。並確認了icFSP1能夠濃度依賴地誘導各種癌細胞發生鐵死亡。使用螢光顯微鏡觀察作用機制時發現,加入icFSP1後,FSP1從其他蛋白質中分離出來並凝聚,從而相分離並誘導鐵死亡。此外,對植入黑色素瘤的小鼠進行腹腔注射icFSP1後,還確認到能夠抑制癌症的增殖。中村說:「這種藥物在生物體內的穩定性等還不夠完善,所以我們正在進行不同的化學修飾,以開發出具有更高生物體內穩定性的化合物。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Nature
論文:DHODH inhibitors sensitize to ferroptosis by FSP1 inhibition.
DOI:10.1038/s41586-023-06269-0













