自然科學研究機構生命創成探究中心特任研究員南慎太朗(研究當時)、特任研究員古賀(巽)理恵(大阪大學蛋白質研究所助教)、古賀信康教授(大阪大學蛋白質研究所教授)與理研(理化學研究所)、名古屋大學、大阪大學等合作,全球首次在理論和實驗兩方面闡明瞭自然界尚未發現的未知可摺疊αβ型蛋白質位相結構(位相結構:α-螺旋和β-鏈的二級結構在空間中的排布以及環的連接方式)遠遠多於目前在自然界中已發現的約400種,至少存在約1萬種。相關研究成果已發表在《Nature Structural and Molecular Biology》雜誌上。
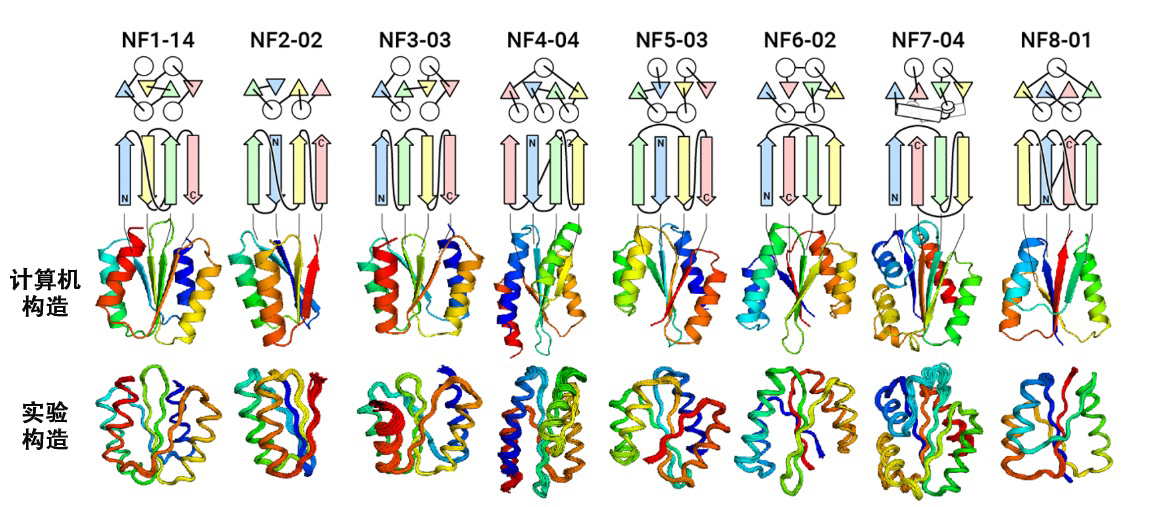
圖1 由計算機設計的新型摺疊蛋白質(供圖:大阪大學)
蛋白質根據胺基酸序列形成特定的空間結構,並通過該空間結構發揮功能。蛋白質分子的胺基酸序列有著巨大的組合空間,即使是100個胺基酸殘基的蛋白質,也存在著約10的130次方種組合方式。如果地球上存在著1000萬種以上的生物物種,假設每個物種有10萬個獨特的遺傳基因,則胺基酸序列的總數約有10的12次方種組合方式。即使如此,和10的130次方這個龐大數字相比格外渺小。這意味著還有大量的蛋白質尚未被自然界探索。
另一方面,儘管每年有1萬個以上的蛋白質結構通過實驗得到解析,但從蛋白質位相結構(摺疊)的角度來看,最近很少發現新的位相結構。在過去的研究中,在理論層面考慮了關於蛋白質的摺疊位相結構是否幾乎已被自然界探索,或者是否還存在許多尚未被自然界所探索的蛋白質的摺疊位相結構,但從未得到實驗驗證。
研究團隊基於物理化學和蛋白質結構數據,提出了一套理論上區分蛋白質分子是否具有可摺疊的位相結構的規則。然後,利用這些規則,對目前蛋白質結構數據庫中不存在的、但被認為可能具有可摺疊性的包含4~8股β-鏈構成的β-摺疊的新αβ型位相結構(總計12,356個)進行了預測。此外,研究團隊利用開發的「從零開始設計包含主鏈的蛋白質分子技術」,在計算機上對其中包含4股β-鏈構成的β-摺疊並形成結紮的共8種新位相結構進行了設計。在驗證設計的蛋白質折疊能力的實驗中,研究人員發現所有這些位相結構的設計都如計算機設計的結構一樣成功地摺疊。這個結果表明約有1萬個尚未被探索的可摺疊αβ型位相結構存在,並且可以認為自然界中還存在許多尚未被發現的可摺疊的位相結構。
基於這些結果,可以考慮到或許是因為生物演化至今時間相對很短,尚未發現所有可能的位相結構,又或許是因為所有地球上的生命有一個共同的祖先,所以在自然界中觀察到的蛋白質位相結構可能存在偏差。
通過對這次實驗發現的約1萬個具有摺疊αβ型位相結構的蛋白質進行設計,有望為醫療和工業領域開發出具有功能性的蛋白質分子。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Nature Structural and Molecular Biology
論文:Exploration of novel αβ-protein folds through de novo design
DOI:10.1038/s41594-023-01029-0













