人類也許能夠開發出一種預防癡呆症藥物,避免β澱粉樣蛋白聚集導致神經細胞死亡而發病。京都大學藥學研究科的白川久志副教授、和歌山縣立醫科大學藥學部的抱將史助教(研究時為京都大學藥學研究科博士生)等人組成的研究團隊闡明,通過刺激溫度/化學物質感測器TRPA1通道,可促進腦内髓鞘的再生。白川副教授表示:「未來,我們希望通過開發刺激TRPA1通道的藥物以及促進其下游釋放LIF(白血病抑制因子)的藥物,從而在神經細胞死亡(導致輕度認知障礙)之前就能得到治療」。相關成果已經刊登於《Science Advances》。
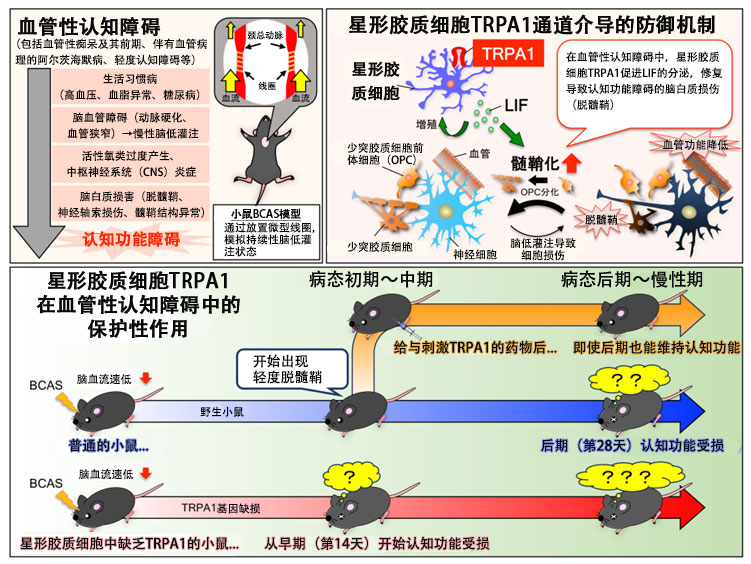
圖1 研究成果概要(供圖:京都大學 白川久志副教授)
近年來,大多數被診斷為阿茲海默症的患者都患有腦血管疾病,有報告稱,80%以上的老年人同時存在阿茲海默症病理和腦血管疾病病理。因此,目前的觀點普遍認為大部分癡呆症至少是兩種疾病的混合型疾病。
特別是因腦血管相關疾病引起的具有認知功能障礙的血管性認知障礙(VCI)不僅包括血管型失智症及其前期的認知障礙,還包括伴有血管病理的阿茲海默症型癡呆、輕度認知障礙(MCI)。多篇研究論文表明,在這些症狀出現之前或初期階段會出現腦血流量減少的情況。
在一項針對400多名75歲及以上受試者的跟蹤研究中,122人在6~7年内患上了癡呆症,其中65人患上了阿茲海默症,而低血壓受試者的發病率是其2倍。一項對1,270名未患癡呆症者(75~101歲)的跟蹤研究發現,低血壓受試者患阿茲海默症的相對風險明顯較高,為1.7。從上述事實可知,後期老年人(75歲及以上)低血壓越嚴重患癡呆症的風險就越高。
在阿茲海默症患者中,可以觀察到腦萎縮,特別是腦白質的嚴重萎縮。構成腦白質的主要成分寡樹突膠細胞可以形成保護神經細胞的髓鞘,防止流向神經細胞的電信號串擾,並有助於信號的有效傳遞。這種腦白質的傷害是由腦血流量減少引起的。
換言之,年齡增長和生活習慣病導致動脈硬化和血管功能下降,引發大腦灌注不足和腦白質傷害,進而導致認知功能下降,此外,神經細胞死亡會促進形成認知功能下降機制。
研究團隊將微型線圈纏繞在小鼠的總頸動脈上,使用相對緩慢的使大腦處於低灌注狀態的BCAS模型小鼠,分析了TRPA1通道在血管性認知障礙中的作用。
將兩個物體放入小鼠籠子中放置10分鐘後,在6小時後僅將一個物體更換為新物體並放入籠子内,發現小鼠更多接觸新物體。然而,TRPA1基因剔除BCAS小鼠並沒有獲得學習效果,對新物體和既有物體的接觸相同。此外,由於腦血流量減少,BCAS小鼠在14天和28天后觀察到腦白質傷害,而TRPA1基因剔除小鼠的腦白質傷害發生的更早。
在實施BCAS手術的野生小鼠的腹腔内,從第15天開始連續10天給與肉桂的主要成分肉桂醛以刺激TRPA1時,完全沒有觀察到腦白質傷害和認知功能障礙。
綜合分析TRPA1刺激後星狀神經膠細胞相關基因的表達情況後發現,白血病抑制因子(LIF)的表達增加。此外還發現,在BCAS野生小鼠的星狀神經膠細胞中觀察到LIF表達增加,但在TRPA1基因剔除小鼠中減少。另外,在培養細胞實驗中,通過將受到TRPA1刺激的星狀神經膠細胞培養液轉移至寡樹突膠細胞前驅細胞(OPC),促進了OPC的髓鞘形成能力。
上述結果表明,星狀神經膠細胞TRPA1通過產生LIF促進髓鞘形成,並在預防因慢性腦低灌注導致的腦白質傷害和之後的早期認知功能障礙發病中發揮著保護作用。
白川副教授表示:「在血管性認知障礙中,據推測,由於星狀神經膠細胞TRPA1促進了LIF的分泌,從而修復了導致認知功能障礙的腦白質傷害(脫髓鞘)。在本次實驗期間(手術後28日内)沒有發生神經細胞死亡。如果可以通過刺激TRPA1促進髓鞘的修復,那麼在伴隨神經細胞死亡的阿茲海默症發病之前預防癡呆本身將成為可能。未來,我們將嘗試通過詳細研究家族分子的參與,同時與其他癡呆症動物模型相結合,全面瞭解癡呆症的發病和防衛機制。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Science Advances
論文:The astrocytic TRPA1 channel mediates an intrinsic protective response to vascular cognitive impairment via LIF production













