全球15%的夫妻面臨不孕不育症的困擾。體外受精-胚移置(IVF-ET)為治療不孕(育)症的方法之一,然而即便篩選、移植了發育良好的胚胎,這些胚胎仍有可能無法順利著床,致使IVF-ET治療只有不到30%的成功率。
對此,由東京大學醫學部附屬醫院婦產科的廣田泰教授、藍川志津特任研究員等組成的研究團隊,利用人子宮內膜以及基因編輯小鼠展開探索,全球首次明確了表觀基因體學異常可導致胚胎著床失敗的現象。
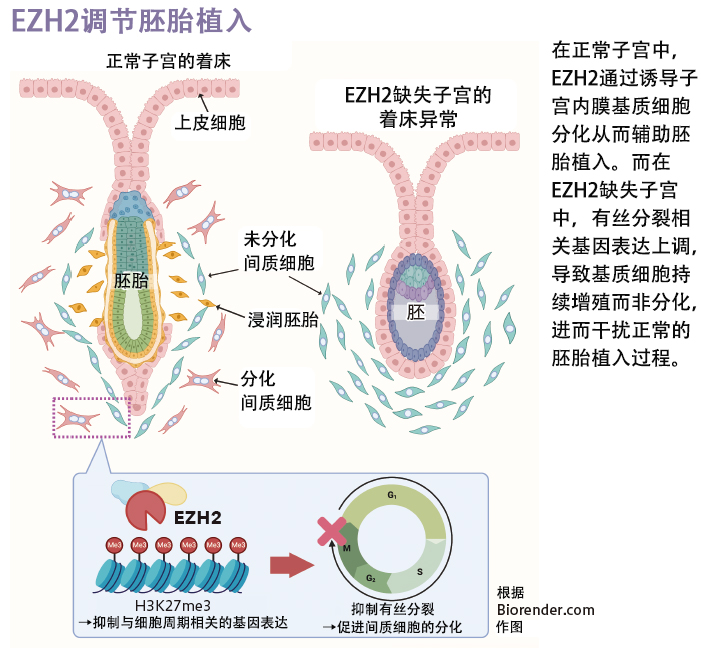
研究者們首先探查了成功妊娠組和複發性植入失敗組婦女著床窗口期子宮內膜的差異表達基因。結果發現,在複發性植入失敗組的内膜組織中上調的基因,多為抑制性表觀基因體修飾--人組蛋白H3第27位離胺酸的三甲基化修飾(H3K27me3)的靶標。
此外,研究組還發現,複發性植入失敗組中Zeste增味劑同源性物2基因(EZH2)表達下調,其編碼的組蛋白甲基轉移酶為介導H3K27me3修飾的關鍵酶分子。
緊接著,研究團隊利用EZH2子宮獨特性缺失小鼠進行實驗後發現,EZH2在著床期子宮內膜中抑制了與有絲分裂相關的基因群表達。在正常子宮內膜中,間質細胞分化為具有多細胞核特徵的蛻膜細胞,從而促使胚胎著床和胎盤形成。而在EZH2缺失子宮中,這種細胞分化幾乎不出現,進而最終導致著床失敗。
本項研究揭示了由EZH2引導的抑制性組蛋白修飾有助於胚胎的成功植入,進一步闡明瞭調控胚胎著床過程中的潛在分子機制。總之,基於子宮內膜細胞分化的評估有望投入到臨床運用,這為今後不孕(育)症的診療手段提供了全新思路。
原文:JSTnews 2023年8月號













