日本北陸先端科學技術大學院大學先端科學技術研究科物質化學前緣領域的都英次郎副教授的研究團隊宣佈,成功開發出了利用液態金屬奈米粒子的癌症免疫療法。研究人員製備出了在液體金屬鎵銦(Ga/In)合金上吸附各種免疫活化物質的奈米粒子,驗證了其具有高穩定性、低毒性以及對細胞膜的滲透性。通過小鼠實驗驗證了這種奈米粒子對癌細胞組織的吸收和治療效果。該成果有望推動開發新的癌症診斷和治療技術。相關研究成果已發表在2023年7月28日的國際學術期刊《Advanced Functional Materials》上。
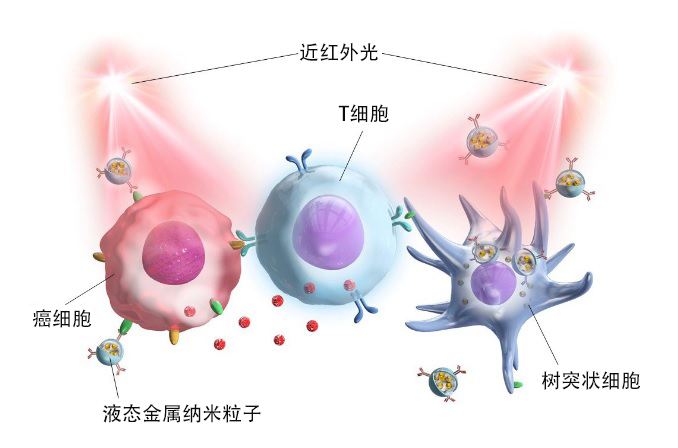
圖1. 近紅外光光照射液態金屬奈米粒子並激活免疫細胞(T細胞和樹突狀細胞)(供圖:北陸先端科學技術大學院大學都英次郎副教授)
由Ga/In合金構成的常溫液態金屬具有高生物相容性和優異的物理化學性質,因此液態金屬奈米粒子在生物醫學領域的應用受到了廣泛關注。
研究團隊認為,如果能夠將具有激活免疫作用的物質與液態金屬相結合,靶向傳送到癌症部位,那麼不僅有望通過免疫系統產生強大的抗腫瘤效果,還有望通過能穿透生物體的近紅外光光,來實現腫瘤部位的視覺化以及光熱轉化,從而實現對新型癌症的診斷和治療。
為了將液態金屬傳送到癌症部位並激活免疫細胞,研究團隊嘗試製備了一種在液體金屬上吸附免疫檢查點抑制劑(抗PD-L1抗體:通過與癌細胞和抗原呈遞細胞上發現的PD-L1結合,阻止與T細胞上的PD-1發生相輔作用。結果顯示具有抗腫瘤作用)、免疫調節劑(咪喹莫特:激活樹突狀細胞,用於早期基底細胞皮膚癌和特定皮膚疾病的治療藥物,英文:Imiquimod)、螢光試劑(吲哚菁綠:用於肝功能檢查的綠色染料。在近紅外光光照射下會發出近紅外光螢光。英文:Indocyanine Green)以及聚乙二醇-磷脂化合物(可使脂溶性藥物具有可溶性,常用於藥物遞送系統)的奈米粒子。
這種液態金屬奈米粒子具有10天以上的粒徑穩定性,對細胞膜顯示出高滲透性。由於已確任其不具備毒性,在近紅外光光照射下能夠產生熱效應,因此針對其在癌症視覺化和治療效果進行了調查。
將液態金屬奈米粒子注射到移植了大腸癌一週以上的小鼠體內,並在24小時後照射了740~790nm的近紅外光光。圖像顯示只有癌症部位發出了螢光,這表明該奈米粒子通過EPR效應(粒徑控制在100nm以下的微粒子不會滲透到正常細胞中,只會從腫瘤血管進入癌組織並在患部積聚)被癌症組織吸收。
因此,對聚積了該奈米粒子的患部使用808nm的近紅外光光進行了照射,通過14天的免疫活化和光熱效應成功地完全消除了癌症細胞。
此外對液態金屬奈米粒子的細胞毒性和生物相容性進行了評估,結果表明奈米粒子沒有細胞毒性,對生物體的影響極小。
該液態金屬奈米粒子不僅展示了其在癌症診斷和免疫治療基礎方面產生作用,還有望作為奈米技術、光學和免疫學等材料設計的基礎技術在多個領域推廣應用。
都副教授表示:「光免疫療法已經進入實際應用階段,但並不適用於所有癌症治療。我們期望今後液態金屬奈米粒子能夠用於平價且安全的癌症治療中。此外,我們還希望通過該技術實現低價且便捷的癌症診斷。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Advanced Functional Materials
論文:Light-Activatable Liquid Metal Immunostimulants for Cancer Nanotheranostics
DOI:10.1002/adfm.202305886













