東京醫科齒科大學難治疾患研究所的岡澤均教授和藤田慶太非常勤講師等人組成的研究團隊與東京都健康長壽醫療中心合作,發現了巴金森氏症致病蛋白質α-突觸核蛋白(α-synuclein)的新搬運模式。研究團隊對小鼠腦中α-突觸核蛋白的擴散情況進行分析後發現,α-突觸核蛋白以單體形式通過腦内淋巴系統快速搬運到遠處區域並在到達處形成聚集體。這一發現可能意味著與異常蛋白密切相關的神經退行性疾病也具有同實體模型製,有望成為這些疾病的治療新靶標。相關研究成果已於2023年8月8日發表在國際學術期刊Cell Reports上。
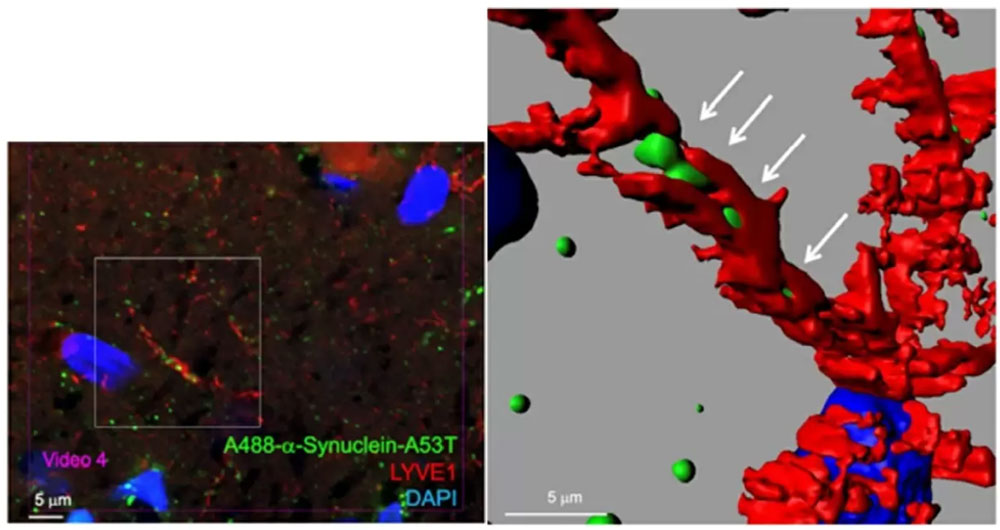
圖1:使用超高解析度顯微鏡觀察腦内淋巴管中α-突觸核蛋白的搬運過程。右圖為左圖局部經影像處理軟體放大處理後的結果。(供圖:東京醫科齒科大學)
巴金森氏症是一種典型的神經退行性疾病,在日本有大約20萬患者並呈增加趨勢,其特徵是腦神經細胞内α-突觸核蛋白(α-synuclein)的積累和聚集。一般認為α-突觸核蛋白從腸道神經細胞經過通過迷走神經搬運到腦幹,進而導致異常蛋白質像感染病毒那樣增加(Prion假說),能觀察到異常蛋白質凝聚的疾病,如阿茲海默症等可能也具有同樣的病理。已經有研究顯示,在給巴金森氏症患者移植的胎兒神經元中觀察到了α-突觸核蛋白的凝體,將α-突觸核蛋白凝體注入小鼠腦後觀察到了路易體(蛋白質聚集體),小鼠出現了類似帕金森的症狀。
本次研究團隊使用嗅球投射外側前額葉處長期表達α-突觸核蛋白的小鼠模型,對來自患者的α-突觸核蛋白是如何在腦內擴散的情況進行了調查。嗅球被認為是α-突觸核蛋白傳達的途徑之一。
研究發現,α-突觸核蛋白在用藥2周內擴散到整個大腦,神經細胞内也得到了確認,α-突觸核蛋白以小分子單體的形式到達了距離注入點較遠的區域。12個月後確認到,α-突觸核蛋白在到達處形成了聚集體。
此前主流的假設認為,α-突觸核蛋白是在先形成聚集體後再經神經元傳達到另外一個神經元的。但這種假設與到達距離腦部遠處的α-突觸核蛋白為單體形式的現象不一致。
對此,研究團隊使用超高解析度顯微鏡從多個角度對血管內皮細胞和α-突觸核蛋白之間的位置關係進行了調查。結果顯示,在血管内部並不存在α-突觸核蛋白單體。之後用同樣方法調查了α-突觸核蛋白單體與淋巴管上皮細胞的位置關係,結果在淋巴管内確認到了α-突觸核蛋白。
研究人員認為,α-突觸核蛋白是沿著血管外部延伸的大淋巴管分支,最終到達神經元,並在神經元内部成長為聚集體的。
由於病源α-突觸核蛋白單體被迅速搬運到大腦全域,因此病情的發展可能比此前認為的更快。本次研究明確的α-突觸核蛋白搬運模式並沒有否定此前的假設,而是揭示了淋巴管這一α-突觸核蛋白的新搬運途徑。
迄今為止,神經退行性疾病的治療藥物主要以聚集體為靶點,但本次研究表明,若以更小的α-突觸核蛋白單體和寡聚體為靶點,有可能開發出更有效的治療藥物。另外,淋巴系統在大腦中的作用還有許多不明之處。
岡澤教授表示:「關於淋巴管的研究仍處於初期階段,我想知道該領域的研究人員會如何看待此次發現。同時,我們也還將繼續研究如何阻斷神經退行性疾病在神經元内外的毒性。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Cell Reports
論文:Mutant α-synuclein propagates via the lymphatic system of the brain in the monomeric state
DOI:doi.org/10.1016/j.celrep.2023.112962













