京都大學iPS細胞研究所(CiRA)的北悠人研究員(研究當時)和堀田秋津副教授等人組成的研究團隊發表研究成果稱,開發出了一種誘導杜氏肌營養不良(DMD)患者來源的iPS細胞進行外顯子豎鍛的雙重CRISPR-Cas3系統。利用兩個CRISPR-Cas3,可一次性剔除存在於該疾病中的外顯子45~55區域的大片段基因。研究團隊對利用源自患者細胞的iPS細胞使用該系統後,確認抗肌萎縮蛋白得到了恢復。該成果有望為開發新的DMD治療方法提供幫助。相關研究成果已於2023年8月15日發表在國際學術期刊《Stem Cell Reports》上。
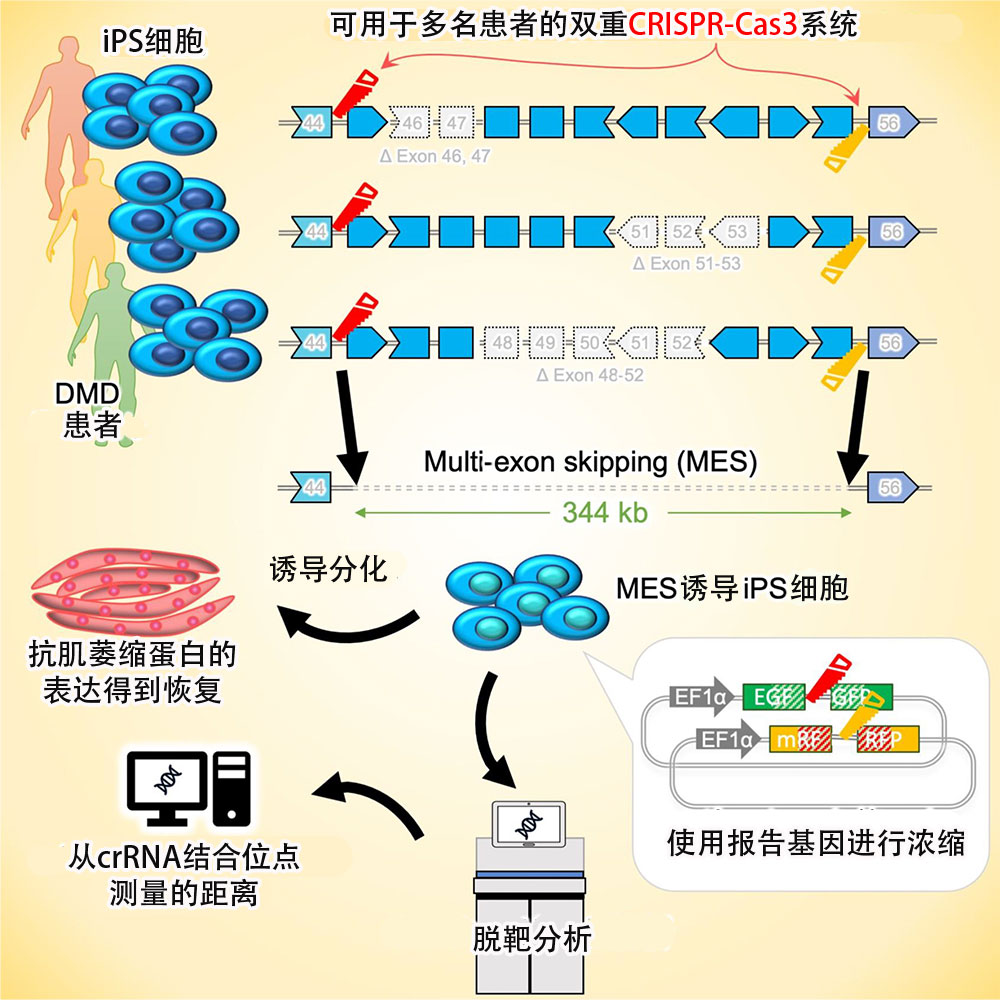
圖1 研究概要(供圖:京都大學)
DMD是一種維持肌細胞的重要蛋白質——抗肌萎縮蛋白的基因突變引起的全身肌肉萎縮性X連鎖性遺傳病,主要發病於男性兒童,是兒童發病率最高的肌肉萎縮症。日本約有2000至3000名患者,平均壽命較短,約31歲。
抗肌萎縮蛋白基因是由79個外顯子組成的巨大基因,其中任何一個外顯子發生突變都會導致抗肌萎縮蛋白的功能障礙從而引發肌肉萎縮症。突變的位置因人而異,迄今為止研究人員一直在開發針對不同突變位置來恢復抗肌萎縮蛋白的方法。其中,外顯子豎鍛備受關注,NCNP等組織已在日本和美國等地銷售可以跳過外顯子53的核酸藥物。
約有60%的患者在外顯子45~55的區域位置(344kb)中發生突變,有報導稱,通過誘導多外顯子豎鍛(MES)一次性跳過該領域可以恢復在該區域存在突變的患者的抗肌萎縮蛋白。缺失該區域的患者被分類為輕度的貝克型,幾乎沒有肌肉症狀。
然而,已普及的CRISPR-Cas9僅能實現數b單位上極小片段的缺失,難以實現大片段基因體缺失。
對此,研究團隊考慮使用兩個比CRISPR-Cas9能對更大片段進行基因編輯的CRISPR-Cas3系統,製作一個從兩端刪除外顯子45~55區域基因的雙重CRISPR-Cas3系統。CRISPR-Cas3系統是在日本開發,可缺失20至60kb的片段。
結果發現,該系統與Cas9相比,雖然效率較低但可以更有效地誘導MES。另外研究團隊還開發出對缺失成功的細胞群進行濃縮的方法。
研究團隊使用該系統對相同範圍但基因突變位置不同的3名DMD患者的細胞所製備的iPS細胞進行了MES誘導。
結果顯示,無論是哪個患者來源的iPS細胞,最終都得到了成功刪除了344kb的該區域片段的細胞。通過將其誘導為骨骼肌,確認MES誘導之前不能產生抗肌萎縮蛋白的患者細胞,現在可以產生抗肌萎縮蛋白。
此外還通過全基因體分析確認到,MES誘導的各細胞沒有發生預期之外的缺失(脫靶效應)。
使用該系統製備的細胞可用於修復因病情發展而失落的肌肉。
堀田副教授表示:「通過使用該系統,即使有數百名患者,也可以使用相同的方法恢復抗肌萎縮蛋白。我們的目標是以非常簡單的方式低成本地實現治療用細胞的生產線。如果今後運輸技術發展到能將CRISPR-Cas3送至體內,我們認為可以將其應用於體內基因療法(In vivo Gene Therapy),在患者體內恢復抗肌萎縮蛋白。」
原文:《科學新聞》
翻譯編輯:JST客觀日本編輯部
【論文資訊】
雜誌:Stem Cell Reports
論文:Dual CRISPR-Cas3 system for inducing multi-exon skipping in DMD patient-derived iPSCs
DOI:10.1016/j.stemcr.2023.07.007













