東京醫科齒科大學難治疾患研究所的鳥居曉項目副教授、清水重臣教授、順天堂大學研究生院醫學研究科的佐藤榮人專任副教授、服部信孝教授等人組成的研究團隊明確了由PARK22/CHCHCHD2基因突變導致的巴金森氏症發病機理。相關成果已發表在EMBO Molecular Medicine線上版上。
供圖:東京醫科齒科大學
目前已知,巴金森氏症的發病與中腦黑質多巴胺能神經元的變性和脫落有關。雖然大多數巴金森氏症病例是散發性的,但也有因α-突觸核蛋白等基因突變導致的家族性巴金森氏症。近年來,研究發現CHCHD2是家族性巴金森氏症的致病基因(PARK22),也是散發性巴金森氏症的風險基因,但對於巴金森氏症的發病機理還有許多未知的部分,改善疾患的方法也不明確。
此次研究團隊明確了CHCHD2中導致多種疾患的突變——第61位蘇胺酸轉變為異白胺酸的T61I突變是導致巴金森氏症發病的機制。
將來自小鼠的神經母細胞瘤Neuro2a細胞進行神經分化後發現,CHCHD2野生型(CHCHD2WT)會分佈在粒線體中,而T61I突變型(CHCHD2T61I)雖然會一度進入粒線體,但隨後又會移動到粒線體外。由於這種定位錯誤,CHCHD2T61I通過召集CK1ε/δ,激酶活性引起α-突觸核蛋白和神經絲構成因子(NEFL)磷酸化,結果誘導形成了聚集體。
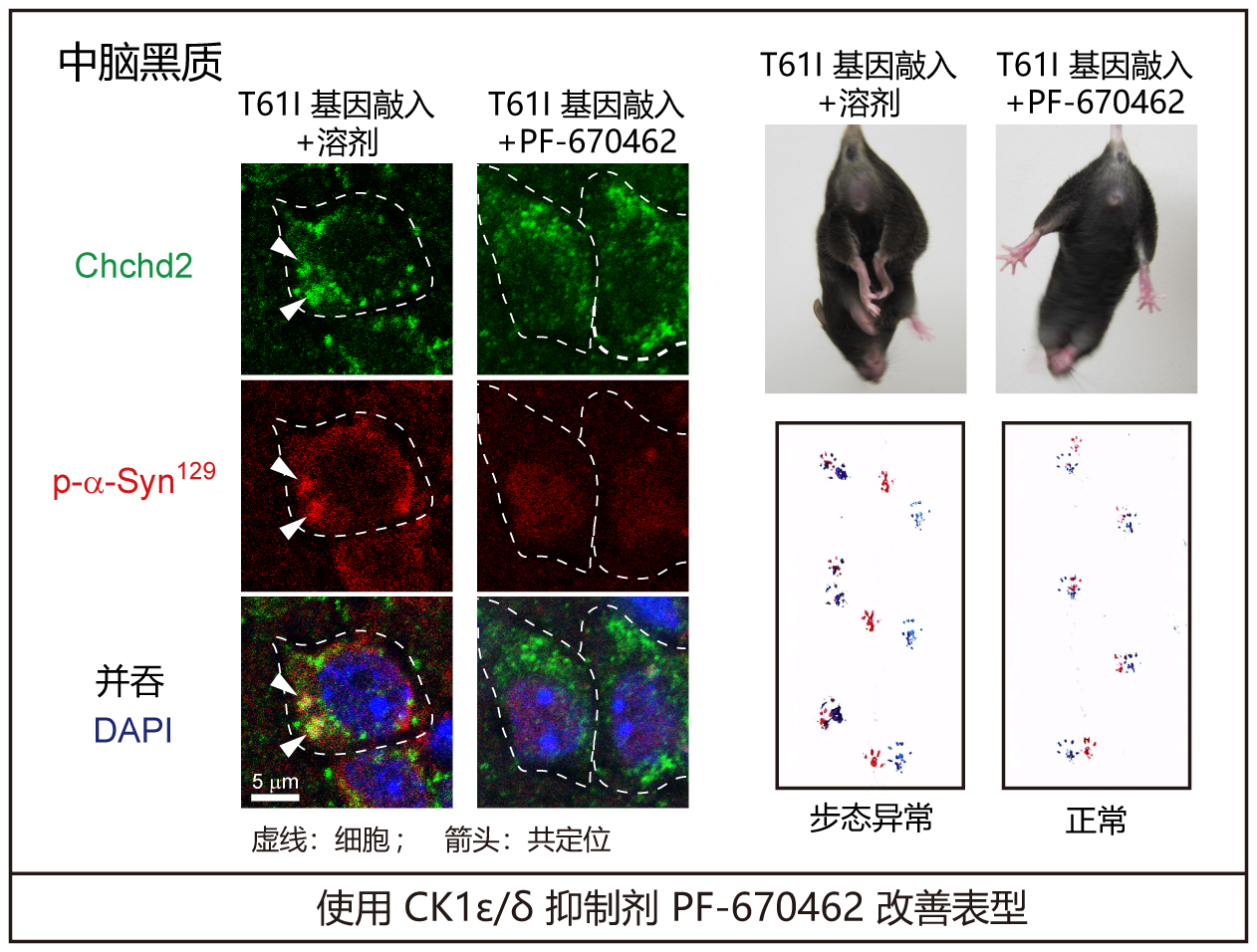
使用小鼠的分析表明,Chchd2T61I基因敲入小鼠和轉基因小鼠的多巴胺能神經元中均形成了含有Chchd2T61I、CK1ε/δ、磷酸化α-突觸核蛋白和磷酸化NEFL的聚集體,同時觀察到神經變性特有的步態異常和運動功能障礙。在死亡的巴金森氏症患者的大腦和由源自患者的iPS細胞製成的多巴胺能神經元中也觀察到了類似的聚集體。
為此,研究人員用CK1ε/δ抑制劑PF670462處理細胞和小鼠後,發現可顯著抑制α-突觸核蛋白和NEFL的磷酸化。此外,PF670462還能抑制多巴胺能神經元的細胞死亡,並改善Chchd2T61I突變基因敲入小鼠的抓握行為和步態異常等神經退行性表型。
鳥居項目副教授表示:「雖然這次我們重點就CHCHD2的T61I突變進行了實驗,但我們認為這種現象還可能與目前尚不清楚病因的的散發性巴金森氏症有關。由於在α-突觸核蛋白的磷酸化這一點上是共通的,所以我們將以此為靶點,進一步開發散發性巴金森氏症的治療方法。」
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:EMBO Molecular Medicine
論文:Involvement of casein kinase 1 epsilon/delta (Csnk1e/d) in the pathogenesis of familial Parkinson’s disease caused by CHCHD2
DOI:doi.org/10.15252/emmm.202317451