目前雖然許多癌症的生存率在不斷提高,但胰腺癌仍是最難治的癌症,其5年生存率僅為6%,發現時往往為時已晚。京都大學醫學研究科消化器内科學的益田朋典醫員、福田晃久講師、妹尾浩教授、分子腫瘤學的野田亮名譽教授等人組成的研究團隊發布研究成果稱,發現膜蛋白RECK的表達減少在胰腺癌的發病和轉移中起著重要作用。野田名譽教授表示:「RECK基因在癌症中發生突變的情況很少。由於該基因並沒有破損,只是失活了,因此通過使用激活藥物,或許能夠開發出胰腺癌的新治療方法」。相關成果已刊登在《Journal of Clinical Investigation》雜誌線上版上。
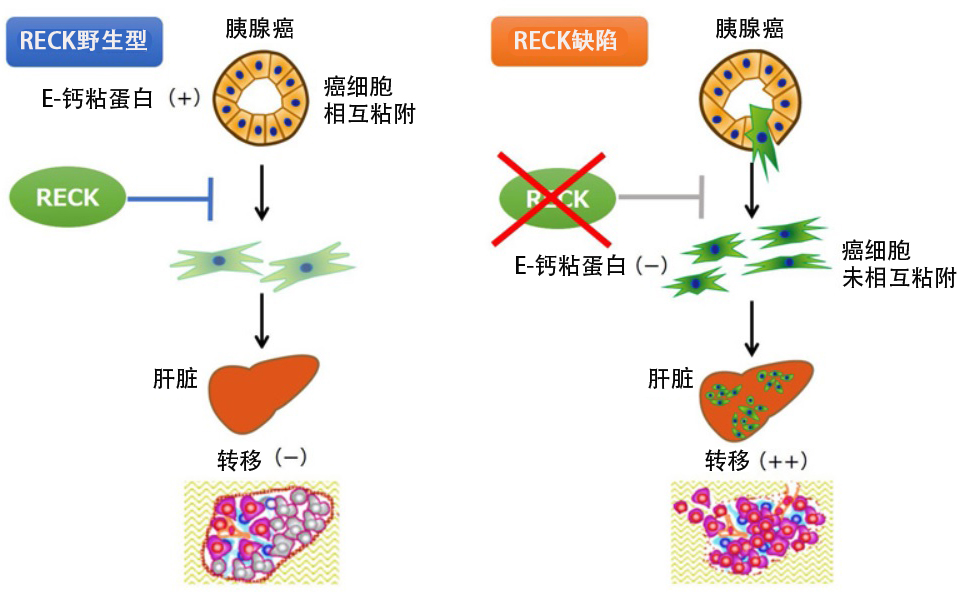
圖 RECK通過增加E-鈣粘蛋白的表達來抑制胰腺癌細胞的浸潤和轉移。(供圖:京都大學)
RECK(Reversion-inducing Cysteine-rich protein with Kazal motifs)是在尋找能使因癌基因K-RAS惡性轉化的小鼠纖維母細胞恢復正常的基因過程中發現的一種膜蛋白。它具有多個功能域,已知可抑制細胞表面的蛋白質分解並協助信號轉導。儘管RECK基因突變在許多癌細胞中很少見,但已知其表達量低於正常組織。
研究團隊製作了具有多種導致胰腺癌的基因突變的KPC小鼠。在KPC小鼠中,儘管RECK在癌前病灶中表達,但在胰腺癌中表達顯著減少或消失。人胰腺癌組織也是如此。
在引入了幾乎存在於所有胰腺癌病例的Kras基因突變的KC小鼠中,只有10%的小鼠患上了胰腺癌。另一方面,在引入Kras基因突變的同時胰腺獨特性敲除RECK後發現,胰腺癌發病率升高,並且發生肝轉移。
RECK基因剔除小鼠所患的胰腺癌中,細胞間粘附所需的E-鈣粘蛋白的表達明顯減少,並轉變為在組織學上更容易浸潤的間質系表徵。此外,所有添加p53雜合性缺失的KC小鼠均形成胰腺癌,但並未發生肝轉移,而當RECK被敲除時,肝轉移發生率提高。換言之,RECK可以抑制胰腺癌的發病和轉移。
研究人員還以患胰腺癌的KPC小鼠為對照,對源自胰腺上皮的細胞進行了細胞譜系分析。結果發現,在KPC小鼠的胰腺癌中,間質中完全沒有觀察到胰腺上皮細胞來源的細胞,而當RECK被敲除時,觀察到大量源自胰腺上皮且E-鈣粘蛋白陰性的間質細胞。換言之,RECK基因的敲除改變了小鼠體內胰腺癌細胞的性質,使其從上皮細胞變為間質細胞。
此外,在RECK基因剔除的胰腺癌細胞中,使用逆轉錄病毒在胰腺癌細胞中重新表達RECK時,發現浸潤能力降低。使用肝轉移模型的詳細分析表明,在RECK基因剔除的胰腺癌細胞中,由於E-鈣粘蛋白的表達減少,導致細胞特性變為間充質系。敲除RECK還會導致基質金屬蛋白酶 (MMP2/MMP3) 的表達增加,從而裂解細胞表面蛋白,並降低E-鈣粘蛋白的表達。
對源自患者的人胰腺癌組織的分析也證實,RECK表達量低的人胰腺癌E-鈣粘蛋白表達低,遠處轉移多,分化程度低,且預後較差。此外,所分析的9種人胰腺癌細胞株均未表達RECK蛋白。
上述結果表明,RECK可以增加E-鈣粘蛋白的表達並抑制胰腺癌的發病、上皮間質轉化和轉移,並且通過重新表達RECK抑制胰腺癌的轉移。
福田講師表示:「我們已經發現了一種可以增加RECK表達的低分子化合物,今後,我們將以該化合物為基礎,致力於開發出抑制胰腺癌浸潤、轉移和增殖的藥物」。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Journal of Clinical Investigation
論文:Pancreatic RECK inactivation promotes cancer formation, epithelial-mesenchymal transition, and metastasis
DOI:doi.org/10.1172/JCI161847