
水島升 Mizushima Noboru
東京大學 研究生院醫學系研究科 教授
2017年起擔任ERATO(創造科學技術推進事業)「水島細胞内降解動力學項目」研究主管
導讀:細胞穩定狀態是通過細胞内蛋白質和胞器反復合成和降解來維持的。降解細胞内的蛋白質等並回收與利用營養物質的「自噬(Autophagy,又稱自體吞噬)」作用是許多真核生物中普遍發生的現象,但其作用和機制尚未完全闡明。東京大學研究生院醫學系研究科的水島升教授正在進行相關研究,希望能系統地、定量地明確自噬現象在哺乳動物中的作用和機制。
生物共通的細胞自噬作用
從臨床醫生走上研究之路
人體由數十萬億個細胞組成,通過每個細胞正常運轉維持健康。細胞中充滿了粒線體和內質網等被稱為胞器的細胞小器官和蛋白質,並且為維持細胞穩定狀態反覆被降解和合成。其中一種降解途徑就是「自噬」機制(圖1)。
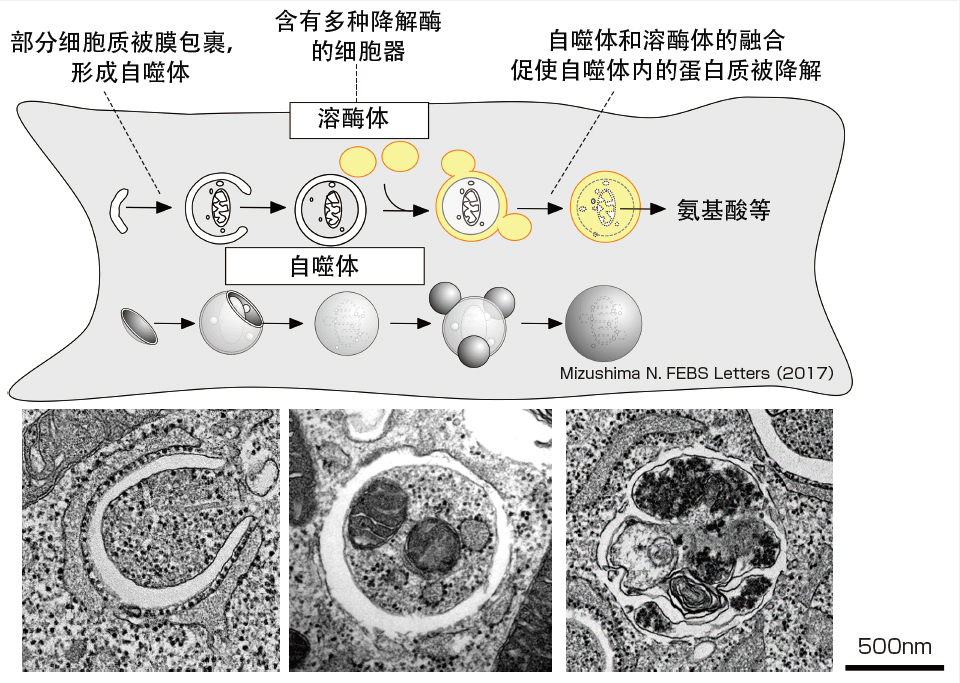
圖1 自噬機制
當誘導自噬時,隔離膜會包裹細胞質中存在的蛋白質和粒線體等,形成「自噬體」。自噬體與溶體融合,内部的蛋白質等被溶體中的降解酶降解。降解產生的氨基酸等降解產物會被吸收利用。
自噬是指細胞的自噬作用,在這種作用中,蛋白質和胞器被稱為「自噬體」的袋狀膜結構裹入,並與含有降解酶的溶體融合,降解自噬體的内容物。降解產生的氨基酸可重新用於蛋白質的合成等。自噬現象早在20世紀60年代就被國外研究人員發現,但在很長一段時間内,關於自噬在生命過程中發揮什麼作用以及發生機制一直都是個謎。
20世紀90年代,東京工業大學榮譽教授大隅良典發現酵母中也存在自噬現象,以及自噬體是在自噬基因的作用下形成的。這一系列研究成果,讓他獲得了2016年諾貝爾生理學醫學獎。研究表明,引起自噬現象的機制在哺乳動物中幾乎相同。此後,在哺乳動物中也陸續發現了與自噬相關的基因。
「自噬是許多生物體共通的普遍現象。此外,它並非發生在身體的某一特定部位,而是遍佈於全身的細胞中的。受這兩點的吸引,我決定從一名臨床醫生轉而走上研究者的道路」,1997年加入大隅研究室、引領哺乳動物自噬研究的東京大學研究生院醫學系研究科教授水島升說道。
跨越專業實現多領域融合
成員每六個月更換一次座位
自噬被認為有兩個主要作用:營養物的回收利用與清除細胞内廢棄物等的品質管理。迄今為止,水島先生設定了自噬研究方向的5個支柱:①闡明在哺乳動物中的作用;②闡明機制;③開發定量測量方法;④闡明與疾病的關係;⑤開發利用自噬的治療方法,目前主要圍繞①和②在推進研究。這些研究需要與超出生物學範圍的物理可用能學和演化學等專業領域相融合。
為此,水島教授召集了眾多研究人員,創立了JST(科學技術振興機構)的ERATO「水島細胞内降解動力學項目」(圖2)。該項目由旨在開發胞器定量分析方法的「胞器動態分析」、主要利用遺傳學全面瞭解脊椎動物細胞内降解意義的「生理泛函分析」、使用數理和物理可用能學方法對自噬過程進行建模的「數理建模」,以及旨在通過基於分子演化角度的數據分析理解自噬機制的「分子與演化」4個小組構成。此外,這4個小組還相互合作,共同推進跨學科融合研究。
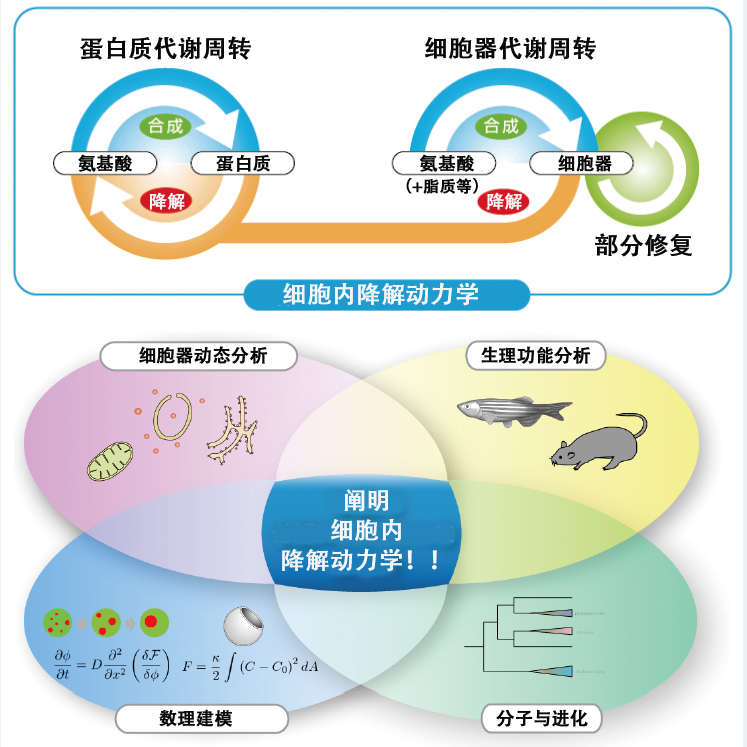
圖2 「水島細胞内降解動力學項目」概要
基於多種學術觀點和方法的技術開發和分析,有望對以細胞生物學、細胞生理學為中心的廣泛基礎研究領域產生連鎖效應,促進對細胞内代謝周轉相關疾病的理解和在治療策略中的應用。
所有項目成員都在同一個房間内研究,座位不是以小組為單位,而是分散就座。每六個月更換一次座位,以便創造出一個不同領域的研究人員可以輕鬆交談的環境。「起初,大家甚至很難理解其他研究人員使用的專業術語,但通過對話,我們開始理解彼此的話語,並且通過接觸不同觀點,還促進了新的研究想法的產生」水島先生說道。
自噬體的膜形成
建模並驗證
跨學科融合研究的成果之一是由數理建模小組主導的「自噬體形成過程中膜變形動力學的數理模型構建及其妥當性驗證」。自噬體的形成過程始於被稱為「隔離膜」的扁平圓盤狀囊泡彎曲成杯狀,最後杯口閉合形成球狀自噬體。普遍認為,使膜彎曲和穩定的曲率因子參與了隔離膜的變形,從而形成自噬體,但目前尚不清楚控制該形成過程的物理可用能機制。
因此,為闡明曲率因子如何控制隔離膜的形成變化,構建了數理模型(圖3、4)。為了確認該數理模型的妥當性,需要觀察實際的細胞内變化。而胞器動態分析小組主導的使用「廣域三維光電子相關顯微鏡法」對胞器進行的定量分析使其成為可能。該分析在同一視角中獲取螢光顯微鏡圖像和電子顯微鏡圖像的光電子相關顯微鏡法中採用了從被稱為陣列式斷層掃描成像(Array tomography)的細胞剖切進行三維重建的方法。
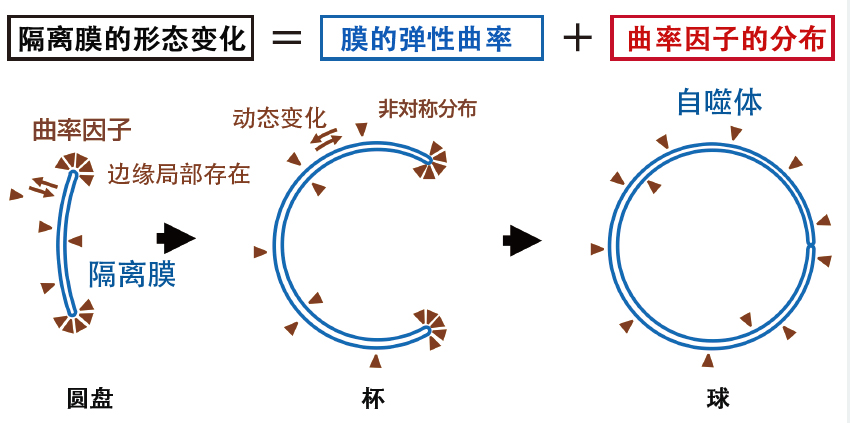
圖3 基於曲率因子引起隔離膜形態變化的數理模型
因曲率因子局部存在於高曲率的邊緣區域,從而降低了膜的彈性曲率能,並穩定了邊緣區域。曲率因子的局域化增加了混合熵能,膜的彈性曲率和曲率因子的分佈決定了穩定的膜形態。通過增加隔離膜的膜面積和改變曲率因子的分佈,可實現連續的形態變化。
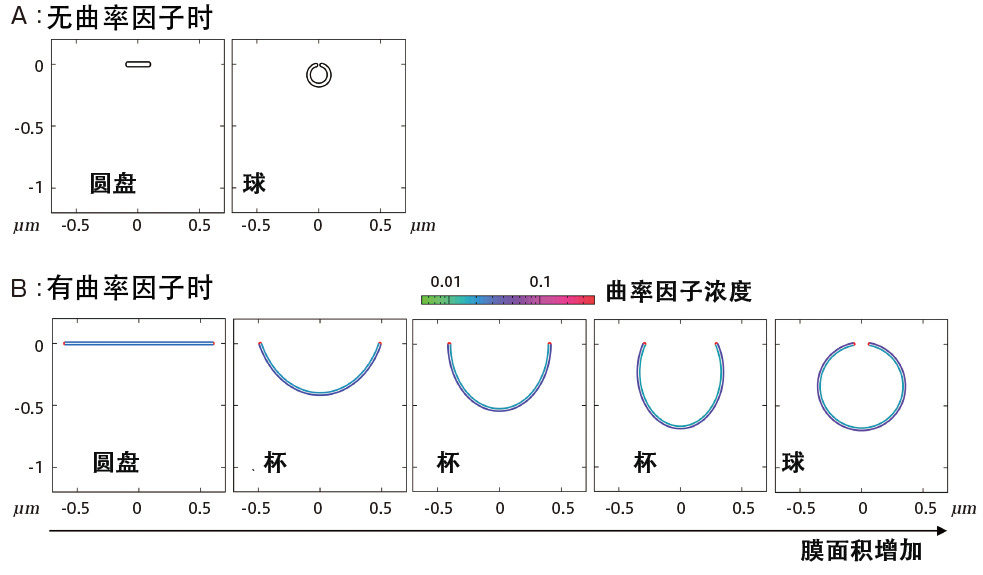
圖4 膜形態變化的數理模型分析結果
在沒有曲率因子的情況下,高曲率邊緣區域無法穩定,在膜面積較小時發生盤狀到球狀的形態變化,但不會出現中間狀態的杯狀(A)。在存在曲率因子的情況下,由於高曲率邊緣區域可以穩定,因此圓盤在較大膜面積内是穩定的,並且在某個膜面積時出現從圓盤到杯狀的形態變化。隨著膜面積進一步增加,將發生從杯狀到球狀的連續形態變化(B)。
建模的具體過程如下,首先在拍攝得到樣品的三維螢光顯微鏡圖像後,用樹脂處理樣品,建立25奈米(一奈米=十億分之一米)的連續超薄剖切,並將剖切放置在矽晶片上,用掃描電子顯微鏡拍攝。通過疊加螢光顯微鏡和電子顯微鏡的2張圖像,成功地在包括數個細胞的廣闊範圍内從細胞頂部到底部以超解析度觀察到了自噬相關的結構(圖5)。
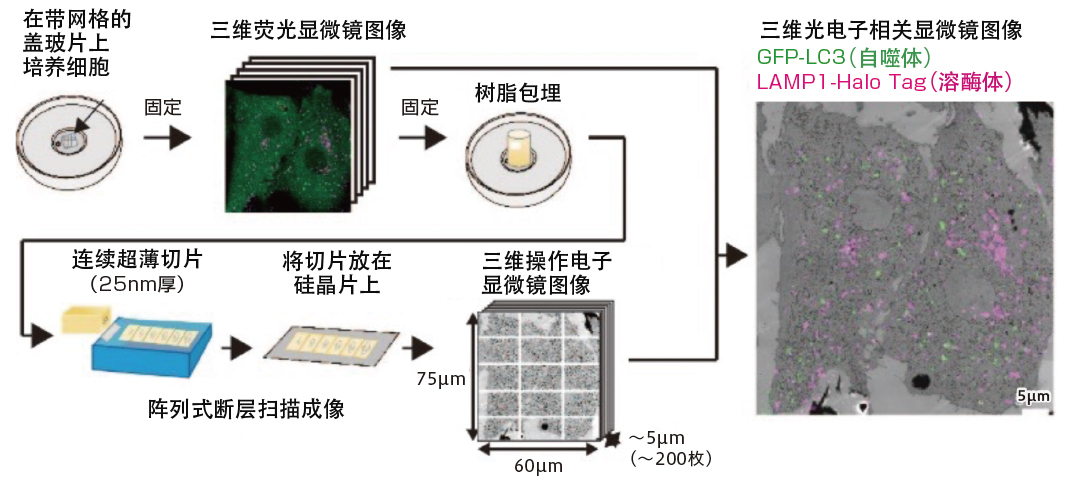
圖5 廣域三維光電子顯微鏡法的開發
通過在同一視角中獲取螢光顯微鏡圖像和電子顯微鏡圖像的光電子顯微鏡法中引入陣列式斷層掃描成像法,可對自噬相關結構體等進行三維定量分析。
利用這種測量方法,可以輕鬆觀察直徑小於1微米(=百萬分之一米)的自噬體隔離膜的形狀,也證明了上述數理模型的妥當性。水島先生總結道:「通過胞器動態分析小組的分析,證實了數理建模小組構建的數理模型的妥當性。這是僅靠一個小組無法取得的進展」。
明確晶狀體透明的機制
構建新的細胞内降解系統
通過自噬研究,水島先生等發現了一種不同於自噬的新的細胞内降解機制,即生理泛函分析小組主導的「發生在眼睛晶狀體中的透明機制研究」。脊椎動物眼睛的晶狀體細胞中原本充滿了內質網和粒線體等胞器。然而,在晶狀體形成過程中,包括細胞核在内的所有胞器全部消失。這一現象本身早在100多年前就已被指出,在發現自噬之後,人們便預測該現象可能是由自噬引起的。
另一方面,水島先生20年前就已證實,即使在不能進行自噬的小鼠體內,晶狀體的胞器也會發生降解,因此其認為晶狀體內發生的細胞内降解應該是自噬所致。 然而,這一機制多年來一直未被闡明。而取得突破性進展的契機是使用了易於修改基因,並且可以在活體狀態下輕鬆觀察細胞和組織的斑馬魚作為模型動物(圖6)。

圖6 斑馬魚
體長約3~4釐米的小型魚類,體表有深藍計算機色縱向條紋。每週產卵一次,數量約200顆,具有適合遺傳學研究的各種特徵。水島研究室飼養了近5000條斑馬魚。
觀察受精後2~3天的斑馬魚晶狀體後發現,粒線體和內質網當場撕裂並散落在周圍,證實其降解機制與自噬不同。研究人員選取了約60種在晶狀體中高表達的基因,製作了缺失每種基因的魚並對其進行研究,結果發現且僅發現一個因缺乏導致胞器無法降解的基因。該發現揭示了晶狀體的細胞内降解與一種名為「PLAAT」的脂質降解酶相關(圖7)。
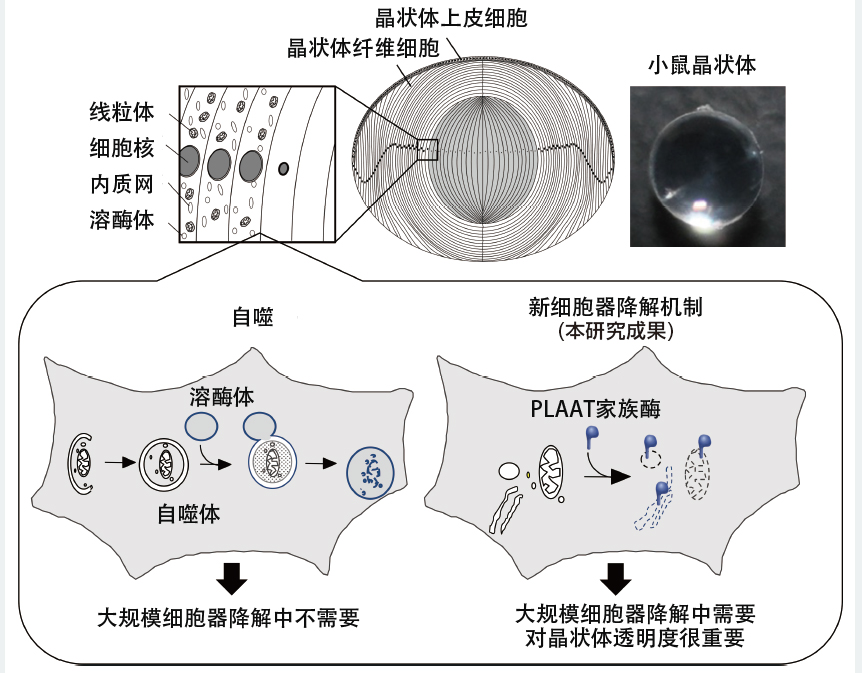
圖7 晶狀體中大規模胞器降解示意圖
晶狀體由上皮細胞及其分化的纖維細胞組成。在纖維細胞的最終分化過程中,所有胞器均被降解(上)。並確認這種降解不需要自噬(左下)。本次研究闡明,晶狀體中胞器的降解是由細胞質基質中存在的脂質降解酶「PLAAT家族酶」引起的,並且這種新型降解系統有助於晶狀體的的透明化(右下)。
此次發現的系統不同於自噬和可選擇性地降解特定蛋白質的泛素-蛋白酶體系統,而是一種新的降解系統。水島先生表示:「如果沒有進行自噬研究,就不可能取得該成果。另外,如果生理泛函分析小組沒有觀察斑馬魚的晶狀體,也不可能取得突破性進展。」
此外,分子與演化小組還揭示了自噬基因在演化過程中會發生變化。此前,研究人員一直認為組成蛋白之間的強共價結合對於自噬體的形成不可或缺,但研究發現,一些生物體即使具有較弱的非共價結合也可以開始膜的形成。水島先生表示:「自噬基因在演化過程中發生了很大變化,有時會簡化其在各種生物體中的功能」。在分子系統研究方面,也發表瞭如開發出可以在細胞水平上準確測量自噬的Halo Tag標記法等成果。
以膜為中心推進基礎研究
實現超越自噬的發現
ERATO的基礎研究對於闡明疾病和老化以及衡量藥物療效也非常重要。對於未來,水島先生表示希望進一步推進基礎研究。其中之一就是闡明「自噬的最後階段發生了什麼」。儘管看起來被自噬體吞噬的結構似乎消失了,但即使蛋白質可以被降解,膜成分卻很難降解,並常常殘留下來。至於膜成分之後會發生什麼變化,目前還不是很清楚。
此外,溶體的降解酶進入自噬體的兩層膜之間,但只有内側的膜被消化酶降解,外側的膜並不會溶解。雖然這兩層膜是原本連接在一起的同一個膜,但其溶解度卻存在差異。對於這一謎團,水島先生表示:「今後我也會將焦點放在膜上進行基礎研究」。
關於ERATO項目中發表的各項研究成果,水島先生分析道,正因為4個小組的跨學科融合,才取得了突破性進展。同樣重要的是,參與該項目的許多研究人員目前正活躍在日本各地多個大學和研究機構中。水島先生表示:「今後,我希望與4個小組的成員一起,繼續研究不侷限於自噬的細胞内降解,並取得超越自噬的發現」。(TEXT:伊藤左知子、PHOTO:石原秀樹)

原文:JSTnews 2023年11月號
翻譯:JST客觀日本編輯部














