人隨著年齡的增長,骨骼肌會逐漸變弱,但其基本機制卻不甚明瞭。日本九州大學研究生院農學研究院的辰巳隆一教授、鈴木貴弘副教授、中村真子教授、中島崇助教、埃及謝赫村大學(Kafrelsheikh University)的阿拉·伊爾加巴里講師等組成的國際聯合研究團隊發布研究成果稱,發現了肌源幹細胞(肌衛星細胞)的活化因子HGF(肝細胞生長因子)在被硝化後會失去生理活性,且這種現象會隨著年齡的增長而進展和累積。辰巳教授表示:「如果能夠實現脫硝化,那麼不僅是年齡增長型肌肉萎縮和再生障礙,還有望促進阿茲海默症和帕金森症等神經退行性疾病的預防和治療方法的開發」。相關成果已發表在《Aging Cell》電子版上。
(供圖:九州大學)
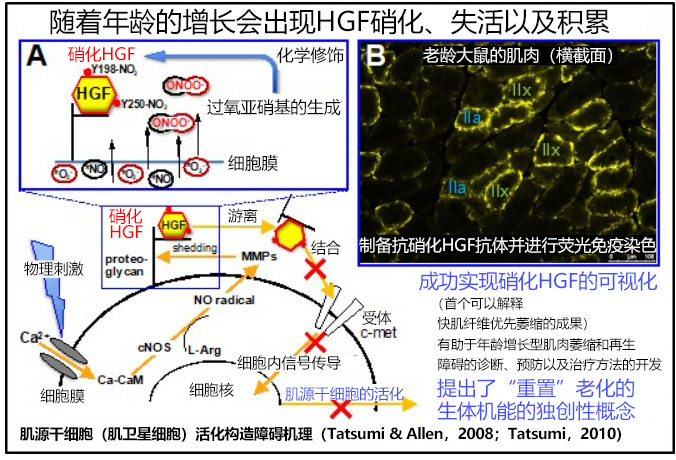
肌源幹細胞在受到物理可用能刺激時會增殖。這是因為結合併儲存在肌纖維周圍的HGF被釋放並與細胞膜接受者c-met相結合,從而激活了肌源幹細胞。隨著年齡的增長,這種功能會停止,導致骨骼肌萎縮(肌肉重量減少)加快和結締組織增加。截止目前的研究中雖然有許多關於基因表現變化的報告,但驅動這些變化的根本機制一直未能明確。
辰巳教授表示:「大約25年前,我們研究了肌衛星細胞的活化問題,但當時未能解釋肌衛星細胞為何沒有活化。15年前,我們認為HGF可能受到了某種化學修飾,但沒能對其進行充分分析,而就在6年前,我們想到了肌衛星細胞可能通過HGF的硝化而失活的想法。」
硝化是酪胺酸殘基側鏈與NO2結合的反應。當一氧化氮(NO)自由基和活性氧結合產生的過氧亞硝基與蛋白質中的酪胺酸殘基結合時,就會發生硝化反應。
研究團隊發現,當HGF被硝化時,就會失去與細胞膜接受者c-met結合的能力。研究團隊還用大鼠證明了這種現象會隨著年齡的增長而發展和積累。另一方面,控制肌源幹細胞增殖和分化的其他細胞生長因子(FGF2、IGF1、TGF-β3)未出現硝化。
此外,研究還發現HGF中發生硝化的酪胺酸殘基(Y)為Y198和Y250。這兩個酪胺酸殘基構成了與c-met的結合位置。
因此,研究人員製作了獨特性識別硝化HGF的單源抗體(硝化Y198HGF抗體和硝化Y250-HGF抗體),並現HGF的硝化在快肌型Ⅱx和Ⅱa型肌纖維中顯著發展和積累。這是世界上第一個能夠解釋人類骨骼肌中快肌纖維優先萎縮的成果。
本次成果的一大關鍵在於單源抗體的建立。即使在混合著多種硝化蛋白質的樣品中也能視覺化硝化Y198和Y250-HGF極大推動了研究的進展。據研究人員稱,該抗體可廣泛適用人、貓、狗、小鼠、大鼠等的HGF,有望應用於人類和寵物年齡增長型肌肉萎縮症的早期診斷等醫療領域。
目前研究團隊正在研究新型基因(脫硝酶)的鑑定和誘導表達,以利用脫硝酶,實現從傳統的「減少氧化壓力」到「恢復因氧化壓力而變性的功能(年輕化)」的重置老化生體機能的獨創性概念。
原文:《科學新聞》
翻譯:JST客觀日本編輯部
【論文資訊】
雜誌:Aging Cell (John Wiley & Sons Inc.)
論文:Age-related nitration/dysfunction of myogenic stem cell activator HGF
DOI:10.1111/ACEL.14041













