隨著新型冠狀病毒疫苗問世而受到關注的RNA(核糖核酸)研究非常活躍。人類現已明白,讓RNA的化學結構發生變化的RNA修飾會影響包括基因工作方式在内的廣泛生命現象,也有可能是疾病的原因。東京大學的鈴木勉教授等正在努力闡明RNA修飾,以便將其能夠應用於疾病治療。
2023年諾貝爾生理學或醫學獎被授予美國賓夕法尼亞大學非常勤教授卡塔琳·考里科(Katalin Karikó)和該校教授德魯·韋斯曼(Drew Weissman)。二人開發了新冠狀病毒疫苗中不可或缺的信使核糖核酸(mRNA)基礎技術。該技術正是從RNA修飾研究中誕生的。
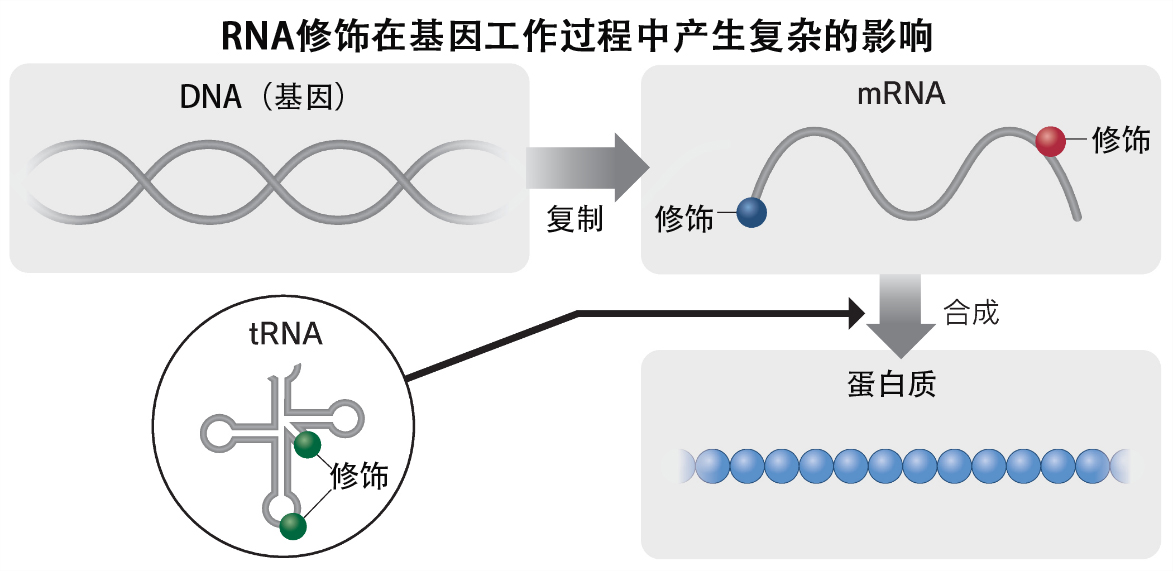
生物體內的細胞合成蛋白質時,並非直接擷取DNA的基因序列,而是產生mRNA作為DNA序列的克隆,並以mRNA為基礎合成蛋白質。考里科等發現,通過改變mRNA的部分化學結構的RNA修飾,在作為疫苗接種時可以避免過度的免疫反應,還能增加蛋白質的合成量。這就是上述兩位科學家開發的基本技術。
細胞内除了mRNA以外,還存在其他各種RNA。介導蛋白質合成的轉運核糖核酸(tRNA)就是其中之一。鈴木教授等發現,通過在tRNA上接附半乳糖和甘露糖等糖類修飾,可以調節蛋白質的合成速度,並於2023年11月在美國科學雜誌《細胞(CELL)》上發表了相關成果。tRNA的糖鍵合結構是已故西村暹博士等在約50年前發現的,但其作用長期以來一直是一個謎。
此次,鈴木教授等成功地確定了將糖接附到tRNA上的酶的基因。當破壞了實驗動物魚的這種基因後,發現魚的生長受到了阻礙。表明魚在正常生長時需要對蛋白質合成速度進行適當調節。鈴木教授等還研究了許多其他RNA修飾,並於2022年在英國科學雜誌《自然》上發表了在tRNA上接附磷酸的修飾的相關發現。
至今為止,在各種生物體中已發現大約150種RNA修飾,其中80%是tRNA。許多疾病被認為是由RNA修飾異常引起的。例如,難治性粒線體疾病MELAS中的基因突變會導致接附在tRNA上的氨基酸牛磺酸修飾急劇減少。鈴木教授等在世界上首個報告了RNA修飾異常導致疾病的案例。目前,除MELAS之外的研究也在推進進之中。
臨床試驗證實,給MELAS患者服用大劑量牛磺酸可以改善症狀,並已投入實際使用。但僅限於對症治療。鈴木教授等正在研究治本的方法。
鈴木教授表示「tRNA最終也將成為藥物」。RNA修飾有多種類型和功能,要加快研究的步伐,分析技術的進步也很重要。預計到2040〜2050年左右,由RNA修飾導致的疾病治療技術有望實際應用和獲得普及。
研究迎來「第2個黃金期」

RNA修飾的研究已有約半個世紀的歷史,日本也做出了很大的貢獻。其代表性成果就是已故古市泰宏和三浦謹一郎二人在1970年代發現的mRNA「帽結構」。該結構存在於RNA的末端,與mRNA的穩定性等有關,也被應用到了新冠病毒mRNA疫苗中。1970~80年代是RNA修飾研究的「黃金時代」,當時發現了在RNA中存在諸多RNA修飾。
在約150種RNA修飾中,80%以上是在20世紀發現的,但研究各種RNA修飾的作用還存在實驗技術方面的障礙。
隨著2003年人類基因體破譯完成,DNA和基因的研究迅速發展。2010年左右,能夠高速、大量分析DNA和RNA序列的「新一代測序儀」開始普及,RNA修飾研究再次活躍。鈴木教授評論道「經歷了寒冬時節之後,我們迎來了第2個黃金期」。
對改變DNA鏈纏繞在周圍的蛋白質和DNA本身化學結構的修飾研究先行取得進展,並因此產生了「表觀遺傳學」科學領域。修飾可改變基因的工作方式,並與各種生命現象和疾病關聯起來。在發現DNA雙螺旋結構的70年後,生物學步入了揭開複雜的RNA修飾的時代。
日文:越川智瑛、《日經產業新聞》、2023/12/1
中文:JST客觀日本編輯部